A preparação pode ser feita sobre lâminas novas, descartáveis, ou mesmo com lâminas reutilizadas, neste caso devendo elas serem tratadas com mistura de ácido crômico e ácido sulfúrico e enxaguadas em água destilada.
Naturalmente, o conhecimento técnico necessário para fazer um bom esfregaço de sangue e medula óssea não pode ser aprendido em um livro, devendo ser adquirida pela experiência prática. Por outro lado, a avaliação fiável das preparações celulares depende da espessura da extensão, da qualidade dos esfregaços e da sua adequada coloração. Por esta razão, alguma instrução sobre a preparação de esfregaço será dada para evitar a produção de lâminas pobres.
Uma boa preparação de esfregaços requer o uso de lâminas rigorosamente limpas, caso contrário, serão frequentes os esfregaços com coloração irregular ou insatisfatória. As lâminas de vidro deverão ser tratadas com uma mistura de ácido sulfúrico crômico, seguida por enxaguamento completo com água destilada, para se obter a limpeza necessária antes da utilização. Também existem lâminas preparadas comercialmente. Algumas com uma seção apropriada para marcação, e que não requerem qualquer pré-tratamento especial. Todas elas devem ser mantidas livres de poeira, em estoque suficientemente grande deve estar sempre à mão.
A preparação de esfregaços de sangue pode ser feito com a borda de uma lamínula ou com o lado menor de uma lamínula de borda suave, cuidando para garantir que não mais do que dois terços a três quartos do slide seja preenchido pelo esfregaço. A técnica de extensão deve ser tal que no filme final alguns dos eritrócitos estejam separados lado a lado e alguns agregados em pequenas manchas que não sejam muito grossas e resultem em superposição e as células individuais não estejam suficientemente espalhadas impossibilitando a análise microscópica da estrutura fina celular.
A aquisição de uma boa técnica de extensão, portanto, é essencial e só é possível por meio de muita prática. Esfregaços de medula óssea podem ser preparados da mesma forma que esfregaços de sangue. A medula aspirada, com ou sem anticoagulante, é coletada em uma grande placa de Petri e o excedente de sangue da medula é drenado, inclinando o tubo. Várias pequenas porções de partículas contendo o aspirado da medula são coletadas do fundo da placa de Petri com a transferência do esfregaço.
O esfregaço preparado desta maneira deve conter numerosas pequenas partículas de medula. Três ou quatro lâminas adicionais devem ser preparadas espremendo partículas de medula isoladas, que foram separadas da medula aspirada com a borda de uma lâmina ou com uma pequena vareta de madeira. Se apenas algumas partículas de medula estiverem disponíveis, o esfregaço de partículas espremidas deve ser usado exclusivamente. Deve-se ter cuidado ao espremer as partículas da medula para preservar as células. Isso pode ser feito sobrepondo uma segunda lâmina sobre o primeira e deslizando sob uma pressão suave, espalhando assim o material particulado em uma camada fina.
Exame microscópico confiável requer que esfregaços de aspirados de medula óssea contenham áreas finas de elementos celulares uniformemente distribuídos, intactos e compactos. Geralmente, esfregaços de medula espessa não são adequados para o diagnóstico morfológico.
A coloração dos esfregaços de sangue e medula óssea devem ser individuais e adaptadas a certos procedimentos de coloração padrão. O procedimento de coloração mais utilizado (Wright / Pappenheim) começa com a aplicação do corante de May-Grünwald por um curto período (4 a 6 minutos), resultando na fixação simultânea de álcool na amostra. Os espécimes devem ser enxaguados com água destilada. As condições de coloração subseqüentes (concentração de coloração e tempo de coloração) com solução diluída de Giemsa devem ser adaptadas às exigências técnicas.
O fator crítico na coloração é o pH da água destilada, que deve ser o mais próximo possível do pH 7,0. Este requisito pode ser difícil de conseguir na prática, mas pode não ser prejudicial aos processos de coloração, desde que grandes variações no pH sejam evitadas.
Um tempo de coloração mais longo é usado com um pH mais ácido, e tempos mais curtos são usados se a água é básica. Se não for possível obter uma coloração universal satisfatória, recomenda-se tamponar a solução de Giemsa da seguinte forma: 1 parte de solução de reserva de Giemsa adicionada a 20 partes de solução tampão de fosfato 0,0667 mol / L, pH 7,0 a 7,2. Alternativamente, pode-se utilizar a substância comercial de Wright (recomenda-se uma das seguintes soluções de álcool metílico: eosina e uma mistura complexa de tiazinas), com uma solução tampão de pH 6,4. O tempo de coloração com esta mistura de tampão-corante é de aproximadamente 15 a 20 minutos. Finalmente, deve ser dada especial atenção à limpeza regular do material de vidro utilizado na preparação da solução Giemsa e à filtração ocasional das soluções de coloração.
Para obter uma indicação preliminar da quantidade e qualidade das células, a rotina de exame da amostra de esfregaço é realizada inicialmente por meio da varredura microscópica da lâmina sob lentes secas de baixa e alta potência. Para este exame, o uso de uma capa fina para reduzir a dispersão de luz da superfície do esfregaço. Muitos exames citológicos podem ser feitos usando a lente seca de alta potência, mas para a avaliação da morfologia dos eritrócitos, uma lente de imersão em óleo deve ser usada. A diferenciação final das células no esfregaço de sangue deve ser realizada com uma lente de imersão em óleo. O exame microscópico deve ser feito na borda da pena (o terço final) do esfregaço: os rejeitos. no entanto, deve ser desconsiderado porque os elementos de células brancas parcialmente danificados que podem levar a falsas contagens de ell são artificialmente concentrados nesta região. Por outro lado, células patológicas específicas podem ser encontradas nesta região da lâmina, bem como nas bordas do esfregaço. Para avaliar com precisão a morfologia eritrocitária, deve-se lembrar que a forma dos glóbulos vermelhos pode ser alterada em porções excessivamente finas ou espessas do esfregaço.
Os aspirados de medula devem também primeiro ser examinados usando objetivas secas para obter uma visão geral da composição celular e para evitar a perda de áreas localizadas de células específicas, tais como grupos de células tumorais ou células de lesões granulomatosas. Quaisquer achados incomuns devem ser examinados cuidadosamente sob imersão em óleo. Um exame microscópico combinado do líquido medular, como descrito, tem quase o mesmo significado que uma contagem de pelo menos 1000 células. Uma combinação de diferenciação qualitativa e quantitativa de esfregaços de medula óssea geralmente não é necessária, exceto para fins específicos de diagnóstico, por exemplo, estabelecimento de fração de blastos.
Todos os profissionais envolvidos em hematologia devem ter uma grande coleção de lâminas. Elas devem ser armazenadas em um estojo e devem ser cuidadosamente limpas com algodão macio ou tiras de musselina saturadas com xilol ou com limpador de lentes disponíveis comercialmente para remover o óleo de imersão após cada exame. Este procedimento evita o desbotamento da mancha através da ação do óleo de imersão,
Regra Geral para o Diagnóstico de Hematologia Microscópica. Apenas um exame de uma combinação de esfregaços de sangue e medula óssea possibilita um diagnóstico completo
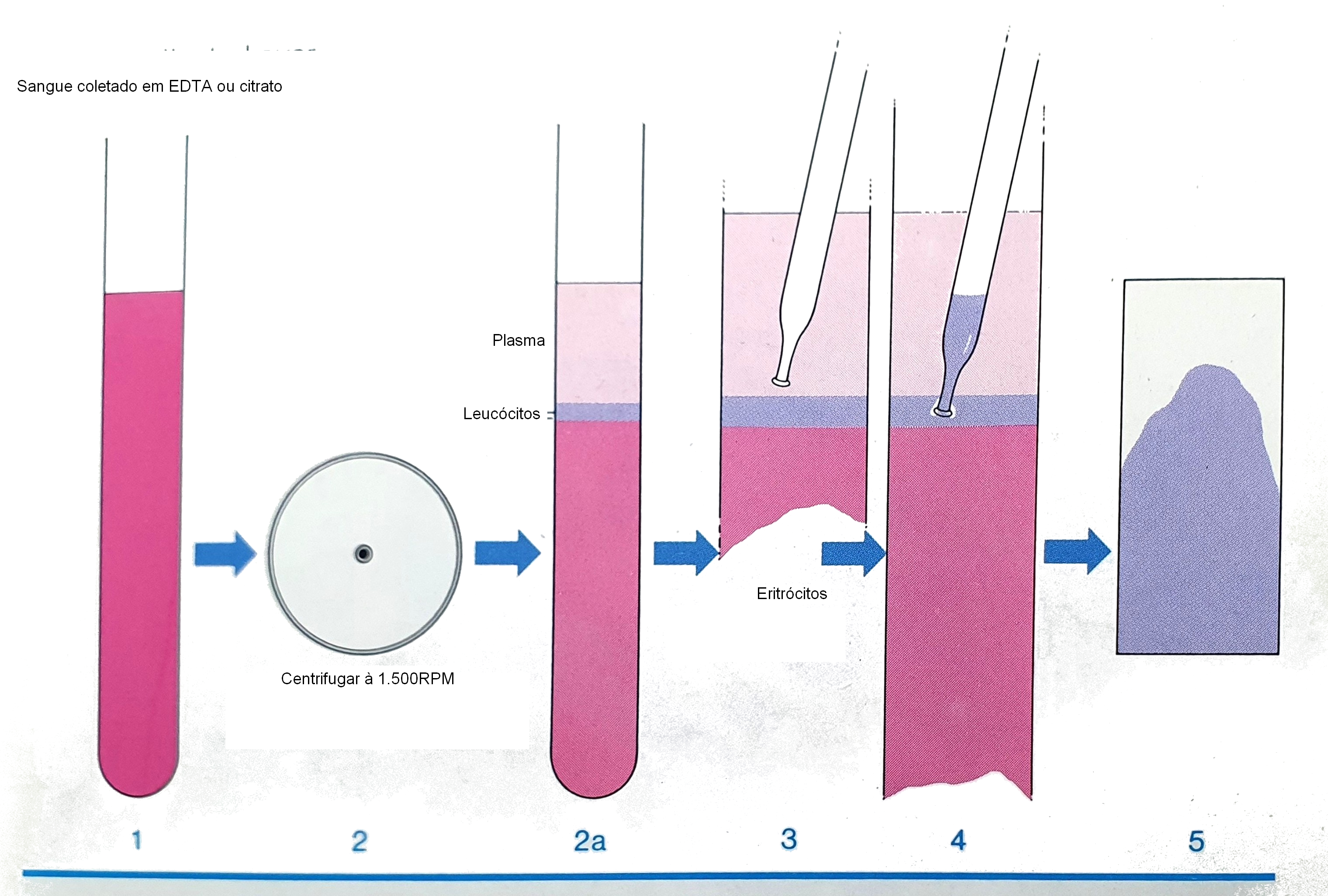
Nas preparações de esfregaço de leucócitos (concentrado de leucócitos) o sangue venoso coletado em um tubo Vacutainer EDTA (líquido ou pó é recomendado. Os tubos vacutainer de citrato de sódio também são aceitáveis).
Os tubos devem estar devidamente preenchidos com sangue e podem ainda dar esfregaços aceitáveis até 3 horas após a coleta. O conteúdo do tubo deve ser cuidadosamente misturado e centrifugado por 15 minutos a 1500 rpm. Após centrifugação e remoção do plasma (com uma pipeta) 0,3 a 0,5 ml da camada leucoplaquetária deve ser coletado com uma pipeta finamente graduada. Uma pequena quantidade de camada de eritrócitos não afeta o exame final. Algumas gotas de camada de leucócitos são então estendidas em lâminas microscópicas, da mesma maneira que o sangue total, e são coradas pelo procedimento de Pappenheim ou por outros métodos citoquímicos.
Indicação para uso de uma extensão de camada leucocitária
1. Aumento do número de células na leucopenia.
2. Exame para células anormais na leucopenia.
3. Reações citoquímicas na leucopenia.
4. Remissão e recaída de leucemias agudas.
5. Procure por cromatina sexual.
Clique para amplicar
[Voltar]