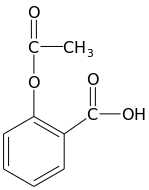
Ácido Acetilsalicílico
Reagentes:
- 20g de ácido salicílico
- 40ml de anidrido acético
- 30 gotas de ácido sulfúrico (d=1,86)
Substâncias complementares:
- Água
- Solução de hidróxido de bário
Técnica:
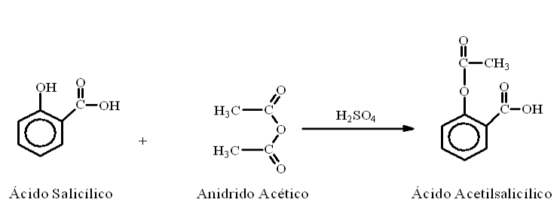
Em um erlenmeyer de 250ml, colocar 20g de ácido salicílico e 40ml de anidrido acético. Agitar intensamente até formação de uma mistura homogênea. Adicionar 30 gotas de ácido sulfúrico concentrado. Haverá dissolução da mistura com elevação da temperatura até 35°C. Se necessário, aquecer para que a temperatura atinja 45°C. A reação, neste ponto, já deverá ter chegado ao fim.
Passar o produto para um becher contendo 400ml de água destilada fria. o ácido acetilsalicílico precipita.
Aquecer até ebulição, mantendo o aquecimento até dissolução do precipitado. Filtrar a quente. Esfriar.
Filtrar em buchner, lavando o produto com repetidas porções de água destilada até que, o filtrado, não apresente reação e precipitado com solução de hidróxido de bário (presença de ácido sulfúrico – H2SO4). Ver mais detalhes abaixo.
Purificar o ácido acetilsalicílico bruto, em um becher contendo 400ml de água, aquecer à ebulição e acrecentar 0,5g de carvão ativo. Aquecer por 5 minutos, filtar a quente por papel pregueado.
Cristalizar por resfriamento em gelo. Filtrar a vácuo, e dessecar em estufa a 100°C por uma hora.
Reação:
Constantes físicas:
Sólido (agulhas ou escamas cristalinas), incolor; PF = 135°C; solúvel em 300 partes de água, em 5 partes de álcool etílico ou em 11 partes de clorofórmio, ou ainda em 20 partes de éter etílico.
* Teste hidróxido de bário na purificação do ácido acetilsalicílico
Este teste é feito para verificar a presença de ácido sulfúrico.
Durante a filtragem para purificação, após cristalizar o ácido acetilsalicílico, colocar uma parte do líquido do filtrado em um tubo de ensaio e pingar algumas gotas de hidróxido de bário. Seu filtrado apresentar um aspecto esbranquiçado, ainda tem ácido sulfúrico. Repetir a lavagem e filtragem, fazendo novamente o teste com o hidróxido de bário até que não haja mais a formação do precipitado “leitoso”.
————————-
Transcrito quase integralmente do livro Química Orgânica Experimental, dos Professores Daniel Gonçalves, Eduardo Wal e Roberto Riva de Almeida, do Departamento de Química do Setor de Ciêncais Exatas da Universidade Federal do Paraná, publicado em 1985, páginas 213-214, Editora Barddal.
[Voltar]
