[Voltar]
Caravela baiana…
Recebi esse texto através de correio eletrônico (e-mail), por ocasião do fiasco das comemorações dos 500 anos do “descobrimento” do Brasil. É muito engraçado, apesar de insultar os baianos. Continue lendo
Vulvite, vaginite e Cervicite
Os órgãos genitais externos, a vagina e o colo do útero estão sujeitos a processos inflamatórios de etiologias diversas cujo sintoma comum é o corrimento.
Vulvite, vaginite e cervicite são frequentes na infância e na puberdade. Podem manifestar-se isoladamente ou encontrar-se associadas, constituindo as inflamações baixas do trato genital.
Neste tópico, as três localizações referidas serão apreciadas em separado com o intuito de facilitar a exposição do tema e de ressaltar as peculiaridades de cada uma delas.
[Voltar]
Sejam bem vindos!
O objetivo deste domínio é levar informação técnica e científica a todos os interessados e amantes das ciências.
Grato pela visita.
Vladimir Antonini – MSc
Mestre em Medicina (clínica cirúrgica)
História do Linux
O Linux é um fenômeno
Nenhum outro sistema operacional deu tanto o que falar nos últimos anos.
Até meados dos anos 90, quem comprava um computador pessoal tinha de escolher entre um PC rodando DOS e Windows ou um Macintosh.
A versão do Unix para PC e o OS/2 da IBM contavam com seus adeptos, mas nunca se tornaram realmente populares. E, qualquer que fosse a escolha, o usuário pagava por ela. O Linux mudou tudo isso e virou mercado de software pelo avesso.
Criado em 1991 por no Linus Torvalds, um estudante finlandês que tinha na programação de computadores seu passatempo predileto, o Linux logo se espalhou pelo mundo. Desenvolvido cooperativamente por programadores de muitos países, esse sistema operacional popularizou o conceito de software livre. Pode ser obtido de graça na internet. Quem sabe programar pode modificá-lo para que atenda melhor as suas necessidades, algo impensável com os softwares comerciais.
Empresas e usuários individuais usando o Linux sem pagar nenhuma licença de uso. Companhias distribuidoras – como Red Hat, Conectiva, SuSE, Oracle, VMware – ganham dinheiro vendendo CDs com software, manuais, suporte técnico, cursos e serviços de consultoria. Um único CD com Linux pode ser usado para instalar o software em centenas de computadores. É completamente diferente do que acontece com os softwares comerciais, que exigem pagamento de uma licença para cada máquina em que serão instalados. É a revolução do software livre.
O mundo do pinguim tem seus heróis, como John “Maddod” Hall,. Fundador da Organização Linux Internacional. Maddod, um incansável divulgador do software livre, já esteve várias vezes realizando palestras no Brasil. ” Desenvolver software não envolve apenas tempo de estudo no desenvolvimento em si. É preciso ter tempo para identificar os bugs do seu sistema e consertá-los você mesmo. Isso o software fechado não permite. É o seu maior problema”, afirma ele.
A fama do Linux, comprovada, é de ser um sistema operacional eficiente, capaz de rodar com bom desempenho mesmo em micros um pouco de antiquados. Também tem escalabilidade, ou seja, suas várias versões rodam em máquinas que vão desde dispositivos de bolso até um grande mainframe. O fato de ser um sistema em que programadores podem alterar e melhorar o software permite corrigir rapidamente as falhas e manter o sistema em contínua evolução.
No início, o termo Linux referia-se apenas ao kernel, a parte central do sistema operacional. Com o tempo, passou a identificar, além do kernel, uma coleção de utilitários e aplicativos que rodam sobre este núcleo. Essas coleções são chamados de distribuições. São as versões empacotadas do Linux. Além do sistema operacional propriamente dito, trazem coisas como ferramentas para administração do sistema, desenvolvimento de aplicativos, interfaces gráficas para o usuário e servidores para internet. Há dezenas de distribuições do Linux, cada um uma com uma seleção de softwares feita por seu respectivo fabricante.
O trabalho desses fabricantes tornou o Linux mais fácil de instalar e de usar. É mais prático encontrar todos os programas básicos num mesmo CD que ficar baixando arquivos isolados na internet. Empresas como Conectiva, Red Hat e SuSE, bem como a Fundação Debian, criaram, por exemplo, utilitários de instalação que já preveem a possibilidade de instalar o Linux junto com outro sistema operacional, como o Windows, no mesmo PC. Isso permite experimentar o Linux sem eliminar totalmente o sistema antigo do micro.
As distribuidoras trocam informações entre si para evitar problemas de incompatibilidade, como um aplicativo de uma distribuição não funcionar em outra, por exemplo. Esses problemas ainda acontecem, mas tem se tornado menos frequentes. O kernel tem sempre um mantenedor, o responsável por aprovar cada aperfeiçoamento. Isso garante que, pelo menos no núcleo do sistema, não vão aparecer versões conflitantes. O primeiro mantenedor foi Linus Torvalds, o segundo, o inglês Alan Cox. No fim do ano passado (ano 2000), os dois escolheram o brasileiro Marcelo Tosatti, 18 anos, para cuidar da versão estável do Linux, ou seja aquela que já está em uso (versão 2.4.X). Entre suas missões estão selecionar as correções que podem ser implementadas no sistema e tornar o Linux compatível com novos computadores e periféricos. Torvalds e Cox continuam responsáveis por supervisionar as versões do kernel que ainda estão em desenvolvimento.
O software que veio do frio
Era uma vez um jovem estudante de computação da Universidade de Helsinque, na Finlândia. Para sua própria diversão, em seu quarto com cortinas que protegiam do sol (mesmo morando num país notavelmente frio), achou que seria uma tarefa interessante melhorar o Minix, uma variação do sistema operacional Unix concebido para fins didáticos. Colocou a idéia em prática com a ajuda de internautas de todo o mundo e acabou criando um novo sistema operacional, o Linux. Sua criação mudou o mundo da tecnologia e popularizou o conceito de software livre. Bem, a história do Linux não é um conto de fadas, mas prova que um patinho feio como Linus Torvalds pode, sim, ter sucesso.
Linus Torvalds nasceu em 28 de dezembro de 1969 e, como ele mesmo se descreve em sua autobiografia – Só por Prazer – Linux, os Bastidores da sua Criação, escrita em parceria com o jornalista David Diamond -, era uma criança feia, de cabelos castanhos (no Brasil, seria considerado loiro), com olhos azuis, sem o menor gosto para escolher roupas e com o tradicional nariz dos Torvalds. Segundo ele, há mais nariz do que homens em três gerações da família.
Por ser gênio da matemática, na escola e tirar boas notas, cresceu e aceitou o fato de ser um nerd, muito antes de isso ser considerado um ponto positivo na personalidade de alguém. O sobrenome Torvalds veio de uma corruptela do sobrenome do avô paterno. Torvald (“domínio de Thor”), que adicionou um “s” para tornar o nome mais sonoro e confundir suecos e finlandeses, que não tem dificuldade para pronunciar a palavra do jeito que ela é atualmente. Por causa do sobrenome estranho, ele sempre aparece na internet como Linus, não como Torvalds – ele afirma que são 21 Torvalds em todo o mundo, e todos são parentes.
Foi por meio do seu avô materno, Leo Waldemar Tornqvist, professor de estatística da Universidade de Helsinque, que Torvalds teve o primeiro contato com computadores. Quer dizer, primeiro foi a calculadora que piscava ao calcular senos e cossenos. Depois veio um Commodore VIC-20, em 1981. “O interesse pela informática começou devagar, e foi crescendo em mim”. Afirma Torvalds. Ele via o avô usando o computador, primeiro como um grande brinquedo, depois como uma calculadora melhorada. Então veio a linguagem Basic, a porta de entrada que levou Torvalds ao mundo da programação. Um dos primeiros programas escritos por ele cumpria a incrível tarefa de mostrar a palavra “Hello” na tela, infinitamente. Tinha duas linhas de código:
10 print “Hello”
20 goto 10
Depois a frase mudou para “Sara is the Best” (Sara é a melhor) para homenagear a irmã mais nova, com quem brigava bastante.
Com a morte do avô, o Commodore passou a ser de Linus. Chegou um momento em que sua mãe, jornalista, assim como o pai, dizia aos amigos que tinha um filho com baixo custo de manutenção em casa. Para deixá-lo feliz bastava guardá-lo em um quarto escuro com um computador e ocasionalmente alimentá-lo com macarrão velho. Linus afirma que os computadores de sua época, por serem menos sofisticados, permitiam às crianças como ele fuçar nos sistemas, o que não ocorre hoje. E os joguinhos eram uma forma de demonstrar isso. Eram feitos sempre em seu quarto com cortinas pretas, uma cama e, ao lado dela, o computador. Contatos com garotas? Só aquelas do colégio que queriam aprender com o gênio da matemática. “Sim, eu era um geek. Sentava na frente do micro e ficava feliz”.
Assim que esgotou os recursos do Commodore VIC-20, Linus Torvalds decidiu que era hora de comprar um novo computador. Ele faz aniiversário próximo do Natal. Na adolescência ganhava dinheiro dos parentes. Juntou mais alguns trocados e optou por comprar um Sinclair QL (isso por volta de 1986/87), que rodava o sistema operacional Q-DOS, tinha processador 6808 de 8 MHz, 128 Kbytes de memória e vinha com Basic avançado – mas nessa época Linus já dominava programação em Assembly. Nada modesto, ele diz que os programas que escrevia, nesta época, já eram perfeitos: “Comprei um controlador de disquetes, mas o Driver para ele era tão ruim que acabei escrevendo meu próprio. Nesse processo, encontrei bugs no sistema operacional, ou pelo menos uma discrepância entre o que a documentação dizia e o que o sistema fazia”, relata em só por prazer. Foi assim que Torvalds mergulhou de cabeça no mundo dos sistemas operacionais, uma aventura que acabaria por levá-lo a desenvolver seu próprio sistema, o Linux..
Minix ou Linux?
Quando entrou na universidade em 1990, o computador de Linus era um velho Sinclair QL. Mas, nesta época, os PCs 386 já eram micros atraentes. Fazendo tudo o que Sinclair fazia e eram produzidos em massa, logo, tinham um preço menor. Linux começou a se desfazer do Sinclair aos poucos, ele pensava que seria divertido comprar uma nova CPU, apesar de não ter dinheiro. Nessa mesma época ele conheceu o livro que mudaria sua vida para sempre e, um tempo depois, o faria ter uma discussão (via Internet, claro) com o autor. O livro era “Sistemas Operacionais: projeto e implantação”, de Andrew Tanenbaum, professor em Amsterdã. A obra descrevia o Minix, projeto criado pelo autor para ser um clone do Unix. Após devorar as 719 páginas, Linus decidiu que queria um computador para rodar Unix. Apesar de a universidade ter máquinas rodando Unix e a partir daquele semestre ter um professor tão novato quanto os alunos no assunto, a versão escolhida para brincar em casa seria o Minix, mesmo.
Chega 1991 e Linus quer comprar um computador que 3500 dólares. O dinheiro recebido no aniversário/Natal não dava para isso, mas era possível financiar o micro, de topo de linha. Ele descreve o computador, que chegou em 5 de janeiro: “Não apenas é um micro sem nome, mas também sem descrição. Era um bloco cinza básico. Não comprei esse computador porque era bonitinho”. O micro funcionava a 33 MHz, tinha 4 MB de memória RAM e rodava MS-DOS. Na livraria local havia um livro sobre Minix, mas o programa teria de ser encomendado. Um mês de espera soou como seis anos.
O Minix chegou numa sexta-feira, e Linus passou o final de semana inteiro descobrindo do que gostava e, principalmente, do que não gostavam do sistema operacional. O emulador de terminal era um ponto que o irritava, pois precisava se conectar ao computador da universidade e a versão criada por Tanembaum não era das melhores. E era inverno na gelada Helsinque. Linus resolveu melhorar o emulador de terminal, mas como não conseguiu, lançou-se à tarefa de projetar e escrever seu próprio terminal.
O projeto do emulador cresceu. Já dava para se conectar com o computador da universidade, ler e-mails e participar do grupo de discussão sobre Minix, mas não para fazer a upload ou download e para isso, precisava gravar os dados em disco. Logo, teria de criar um sistema de gerenciamento de arquivos. Isso deu trabalho, mas ele já via que o projeto se tornaria um sistema operacional. Linux afirma que não se lembra se era dia ou noite quando teve essa idéia, afinal as cortinas cobriam a luz solar. Em 3 de julho, ele envia uma mensagem para um grupo de discussão na Internet pedindo informações sobre regras Posix – padrões que definem o funcionamento do Unix, e a resposta estava na sua própria universidade, em manuais da Sun Microsystems. Começava a nascer o Linux.
GNU não é Unix
No princípio, era o Unix. O sistema operacional que a partir de 1969 foi a base de muita coisa que conhecemos hoje, incluindo o Linux. O Unix nasceu nos Laboratórios Bell, da AT&T, nos EUA. Em 1974, tornou-se um o primeiro sistema próximo ao escrito em linguagem C. É antes dele, o software básico do computador era sempre escritor em Assembly, linguagem específica para cada plataforma de hardware. O uso da linguagem C permitiu criar o primeiro sistema operacional portável, ou seja, capaz de rodar em diferentes computadores. O Unix foi, também, o primeiro sistema operacional totalmente modular. Isso permitiu acrescentar novas funções a ele por meio de módulos adicionais. Com essas características, o Unix pode evoluir junto com o hardware. É significativo o fato de continuar fazendo sucesso 33 anos depois de criado.
O Unix espalhou-se por várias empresas e universidades, e ganhou muitas variantes. No início dos anos 70, Richards Stallman trabalhava como programador no laboratório de inteligência artificial do instituto de tecnologia de Massachusetts (MIT). Ele já fazia parte de uma comunidade de troca de software. seu trabalho? Melhorar o sistema operacional do digital PDP-10 um supercomputador dos anos 70, que parou de ser fabricado no início dos anos 80. Com o fim do PDP-10, e da comunidade criada em torno dele, havia duas opções para Stallman. A primeira a entrar no mundo do software comercial, com suas licenças de uso restritivas, e “Descobrir que, no final da carreira, teria passado a vida fazendo do mundo um lugar pior”, na visão do próprio Stallman. Ele cogitou até abandonar a profissão. A segunda possibilidade vislumbrada por ele era criar sua própria comunidade e, por conseqüência, um novo sistema operacional.
Enquanto estava no MIT, os computadores modernos da época, como o VAX e o 68020, tinham seus próprios sistemas operacionais, mas nenhum software era livre. O usuário tinha de assinar um termo de compromisso para obter uma cópia, sem poder compartilhar os programas livremente. Para mudar algo, teria de pedir ao desenvolvedor. Stallman não concordava com as regras do mercado e decidiu fazer um sistema compatível com o Unix, pois isso tornaria fácil, para os usuários de Unix usá-lo e modificá-lo. Em 1984, Stallman criou a Free Software Foundation (FSF). Seu objetivo era desenvolver o sistema operacional GNU, sigla que vem de “GNU não é Unix”, nome irônico escolhido por uma tradição hacker. A FSF nunca concluiu totalmente seu projeto. Mas Linus Torvalds usou muitos dos utilitários, ferramentas de desenvolvimento e aplicativos do GNU em seu Linux. Sem GNU, não existiria o Linux como o conhecemos hoje.
O pinguim vira símbolo
Por que um pinguim? A ideia surgiu com uma mordida de um deles no dedo de Linus, num zoológico da Austrália. Depois disso, a ave, apelidada de Tux, virou símbolo do sistema operacional.
Linus descreve que pensava que o sistema operacional seria um substituto do Minix, com melhorias naquilo que ele achava ruim ou insuficiente. Quando viu, havia criado um shell, o termo UNIX para interface entre o usuário e o sistema operacional. E a primeira coisa que o kernel, o núcleo do sistema criado por Linus, fazia era acionar o shell, que era um clone do Bourne Shell, um dos shells originais do Unix. Em meados de agosto, o shell estava pronto e com ele era fácil criar e compilar outros programas. O verão na Finlândia estava no auge e Linus continuava trancado no quarto, chamando sistema secretamente de Linux, embora tivesse o nome Freax reservado.
Com a ajuda dos grupos de discussão na web, Linus pedia aos colegas que dissesse o que gostariam de ver no Minix, já que estava criando um sistema operacional como hobby para PCs. Em 17 de setembro de 1991, o shell funcionava e o Linux passava a ser distribuído gratuitamente em um servidor da Internet. A versão era a 0.01, o que indicava que o software não estava tão pronto assim. Eram cerca de 10.000 linhas de código. Hoje, são mais de 10 milhões.
Em outubro, vem a versão 0.02, depois a 0.03. No mês de novembro o software já estava na versão 0.10. Os internautas apareciam com dúvidas para instalar e melhorar o sistema, que começava a fazer barulho na comunidade underground de tecnologia. “De repente, as pessoas começavam a substituir o Minix pelo Linux”, relata Torvalds. O número de usuários cresceu de 5, 10, 20 pessoas identificáveis a centenas de anônimos que, a pedido do Linus, mandavam cartões-postais para sua casa. Os cartões chegavam do mundo inteiro. Daí para o reconhecimento e adoção mundial do Linux por empresas como IBM, e a criação de companhias como Red Hat, VA Linux e tantas outras foi um pulo.
Linus foi o primeiro desenvolvedor do Linux e ainda coordena os trabalhos. Depois dele, Alan Cox foi escolhido como guardião do pinguim e, no ano passado (2001) o brasileiro Marcelo Tosatti, de 18 anos, foi indicado para coordenar as atualizações do kernel estável, ou seja, daquele que já está em uso. Torvalds e Cox continuam cuidando do desenvolvimento de novas versões. Se não fosse pelo esforço do estudante Linus Torvalds, talvez o mundo dos sistemas operacionais fosse um pouco mais inseguro em menos divertido. Hoje Linus trabalha na Transmeta, uma fabricante de chips. Mora no Vale do Silício, nos Estados Unidos e, como sua mãe previa, a mãe natureza fez seu serviço: Linus casou-se com Tove, uma aluna que o convidou para sair por e-mail. Ele tem três filhas e uma BMW Z3. Se houvesse um conto de fadas geek, poderíamos dizer que é o primeiro do gênero, com um final até o momento feliz. Ou que está na versão 2.4. X, como o kernel do Linux.
Qual é o nome mesmo?
Para completar o sistema operacional Linux, Linus Torvalds e sua equipe usaram componentes desenvolvidos pela Free Software Foundation, como parte do projeto GNU, e isso causa uma confusão de nomenclatura: se Linux é o núcleo, mas utilitários do GNU sustentam o software, porque não chamá-lo de GNU/Linux? Pelo menos essa é a visão de Richard Stallman, criador da FSF. “No início dos anos 90, já tínhamos ocupado todo o sistema, exceto o núcleo (e nós ainda estamos trabalhando num kernel, o GNU/Hurd).
Desenvolver esse núcleo tem sido bem mais difícil do que esperávamos, e nós ainda estamos trabalhando em sua finalização. Felizmente, você não precisa esperar por ele, por que o Linux e está funcionando agora. Quando Linus Torvalds escreveu o Linux, ele completou a última grande lacuna”, explica Stallman. “Pessoas poderão, então, colocar o Linux junto com GNU para compor um sistema livre completo, um sistema GNU baseado em Linux, ou GNU/Linux, para simplificar”, diz.
Essa visão causa polêmica, claro. Grande parte da comunidade linuxista, apesar de não questionar a grande contribuição do GNU para o Linux, acha essa nomenclatura uma bobagem. Joe Kaplenk, especialista no assunto e autor de livros sobre sistemas operacionais, lembrou que, para fazer realmente justiça, o Linux deveria se chamar GNU/BSD/AT&T/Unix/Multics/Minix/Linux. Afinal, antes do GNU, já existia software livre. E o Linux incorpora, em suas distribuições, muita coisa do GNU, mas também muito software que não é GNU. Considerando tudo isso, o nome Linux está de bom tamanho, diz Kaplent.
[Voltar]
Dipirona: modo de ação analgésica
INTRODUÇÃO
Analgesia por AINEs é explicada pela ação inibitória da síntese local de PGE2 (Vane, 1971). Essa ação previne o desenvolvimento da hiperalgesia , isto é, a sensibilização dos receptores de dor para estímulos químicos e físicos.
Dipirona é um analgésico e antipirético muito utilizado em diversos países onde sua propaganda é permitida.
Existe uma impressão entre os médicos de que a dipirona tem um efeito clínico diferente dos AINEs. Existem muitos artigos e estudos na literatura mostrando que a dipirona tem efeito analgésico maior que aspirina, que é um antiinflamatório inibidor de COX clássico (Mukherjee et Sudha, 1980; Petrova et al. 1980) ou paracetamol (Daftary et al, 1980), um analgésico do grupo da anilina, e por isso o perfil do efeito farmacológico da dipirona é certamente diferente do que dos AINEs e também dos analgésicos de ação central (Nikolova et al, 1980; Nikolov et al., 1980). No entanto, esse sítio de ação analgésica é um mecanismo controverso. A ação central foi proposta por Von Tomek (1955) e não confirmada por Lorenzetti (1999) que, ao aplicar dipirona intra-cerebroventricular de rato, não conseguiu inibir a hiperalgesia induzida por prostaglandina em pata trazeira de rato.
2 – O QUE É DIPIRONA
Dipirona é o nome genérico de ácido [(2,3-dihidro-1,5-dimetil-3-oxo-2-fenil-1H-pirazol-4-il)metilamino]metanossulfônico, também chamado de 1-fenil-2,3-dimetil-5-pirazolona-4-metilaminometanossulfonato de sódio (ou de magnésio), e ainda denominado de metamizol, um segundo nome genérico e muito encontrado na literatura farmacológica norte-americana e européia.

Com peso molecular de 351,36 e uma distribuição relativa de 44,44% de carbono, 5,16% de hidrogênio, 11,96% de nitrogênio, 6,54% de sódio (7,26% se for magnésio), 22,77% de oxigênio e 9,13% de enxofre, apresenta fórmula empírica C13H16N3NaO4S.H2O (ou C26H32MgN6O8S2. Na dipirona magnesiana ligam-se duas moléculas de dipirona ao cátion magnésio). É preparada a partir da metilação do grupo amino da sulfamipirina, tratada com aldeído metanóico (formaldeído ou formol), em solução de bissulfito de sódio. Muito solúvel em água (1g/1,5ml), é pouco solúvel em etanol e praticamente insolúvel em éter, acetona, benzeno e clorofórmio, sendo um complicador quando é necessário fazer uma cromatografia de camada delgada para diferenciação da dipirona de outros tóxicos e barbitúricos em processos jucidiais onde é pedido a identificação toxicológica com fins forenses, pois os melhores carreadores de moléculas em cromatografia de camada delgada são justamente o benzeno, o éter, o etanol, o hexano e a acetona, sendo o metanol muito pouco utilizado devido à sua toxicidade e a água não ser usada por dissolver a camada de sílica da placa.
Observando a molécula da dipirona, é possível identificar duas estruturas ligantes que tem papéis importantes no mecanismo de ação deste fármaco. O primeiro é o grupamento benzoil, que tem atividade anestésica comprovada, tanto que a maior contribuição da cocaína para a farmacológia foi a identificação dos componentes de sua fórmula estrutural e a descoberta de que, retirando-se o radical benzoil, a cocaína perdia sua ação anestésica (Cavazzani, 1994).

Outro ligante de importância na estrutura da dipirona é o grupamento sulfato, responsável por sua alta solubilidade em água e pela sua facilidade de absorção, é potencilamente agressivo para a medula óssea, podendo causar desde neutropenias, agranilocitoses, até aplasia de medula óssea, uma patologia hematopoiética muito severa que só tem um tratamento, o transplante de medula óssea que, se não realizado em tempo, pode levar o indivíduo ao óbito.
Grupamento sulfato:

Foi patentetada sob nº 254, pelo Laboratório Hoechst em 1911, na Alemanha com o nome de Metamizol® que hoje acabou virando nome genérico, como aconteceu com a Aspirina®, que é marca registrada de ácido acetilsalicílico, desenvolvido pela Bayer e que se consagrou, tornando-se um nome genérico.
3 – MECANISMO DE AÇÃO
Apesar de todas as pesquisas já realizadas apontarem para uma ação bloqueadora da hiperalgesia exercida pela ligação a um receptor periférico, combinado com ação espinal da dipirona e com poucos efeitos antiedematosos e/ou antiiflmatórios, alguns bancos de dados insistem em continuar afirmando que a ação da dipirona atua unicamente por inibição de cicloxigenase, inibindo a síntese de prostaglandinas (Abbate et al, 1990; Anon, 1973; Reynolds, 1994; Gladtke, 1983; Arellano et Sacristan, 1990).
No volume 116, de setembro de 2000 do banco de dados Drugdex (Micromedex) aparece a citação feita no parágrafo anteiror, ignorando os trabalhos realizados entre 1996 e 1999 por Aleksander Zampronio, Berenice B. Lorenzetti e Sérgio H. Ferreira, que apontam para a ação periférica da dipirona sobre um receptor sináptico com estimulação epinhal via ativação da arginina/cGMP em neurônios sensoriais primários.
A ação antitérmica da dipirona pode ser explicada pelo antagonismo direto de cininas pirogênicas em receptores do centro termo-regulador, localizado no tálamo.
4 – FARMACOCINÉTICA
4.1 – INÍCIO DA AÇÃO
Na hipertermia (febre), após administração oral, o efeito hipotermiante começa a aparecer entre 30 minutos e no máximo em uma hora (Ajgaonkar et al, 1988; Giovannini et al, 1986; Reiner et al, 1984). O pico máximo de resposta ficam entre 4 e 6 horas (Ajgaonkar et al, 1988; Giovannini et al, 1986; Reiner et al, 1984).
4.2 – NÍVEL MÁXIMO DE CONCENTRAÇÃO PLASMÁTICA
Após administração oral, pode ser encontrado um nível máximo de concentração após 1 a 2 horas (Vlahov et al, 1990; Flusser et al, 1988; Volz et Kellner, 1980). O nível máximo de concentração plasmática do metabólito ativo 4-MAA encontrado foi de 11, 21 e 41 mcg/ml, após administração oral de 750, 1500 e 3000mg de dipirona, respectivamente (Vlahov et al, 1990). Na realidade e dipirona é uma pro-droga que é metabolizada no trato intestinal em 4-metilaminoantipirina (4-MAA), o metabólito ativo (Vlahov et al, 1990; Flusser et al, 1988; Brune, 1988; Levy, 1986; Volz et Kellner, 1980). O 4-MAA é metabolizado no fígado em 4-aminoantipirina (4-AA), um segundo metabólito ativo (Brune, 1988; Flusser et al, 1988).
A dipirona não apresenta interações conhecidas com alimentos ou então são clinicametne insignificantes (Levy et al, 1995; Flusser et al, 1988).
4.3 – SÍTIOS DE DISTRIBUIÇÃO
Cerca de 58% do 4-MAA e 48% do 4-AA são distribuidos ligados às proteínas plasmáticas (Zylber-Katz et al, 1985). Os metabólitos da dipirona tem sido encontrados no líquido céfalo-raquidiano. Em estudo controlado, 28 pacientes com indicação terapêutica de dipirona, tomando 1g por via oral (dois comprimidos de 500mg) em tempos diversos (6 em 6 horas) foram submetidos a punção lombar em vários intervalos de tempo e colhido cerca de 2ml de líquor sendo detectada a presença dos metabólitos em concentração menor que no plasma, mas guardando uma proporção líquor/plasma de ambos os metabólitos (Cohen et al, 1998).
4.4 – VOLUME DE DISTRIBUIÇÃO
O volume de distribuição do 4-MAA é de 40 litros (Vlahov et al, 1990).
4.5 – METABOLISMO
4.5.1 – PAREDE INTESTINAL
A metabolização da dipirona na parede intestinal é extensa (Vlahov et al, 1990; Flusser et al, 1988; Brune, 1988; Levy, 1986; Volz et Kellner, 1980).
O metabolismo é feito monoenzimaticamene por hidrólise no trato intestinal formando o 4-MAA, um dos seus metabólitos ativos (Vlahov et al, 1990; Flusser et al, 1988; Brune, 1988; Levy, 1986; Volz et Kellner, 1980).
4.5.2 – FÍGADO
No fígado o metabolismo também é grande (Flusser et al, 1988; Brune, 1988; Volz et Kellner, 1980). O 4-MAA é transformado em 4-AA (Brune, 1988; Flusser et al, 1988; Volz et Kellner, 1980) e outros metabólitos inativos e de pouca importância. Em portadores assintomáticos de hepatite B, com função hepática normal, testes demonstraram prejuízo no metabolismo oxidativo da dipirona quando comparado com sujeitos não portadores (Levy et al, 1997).
4.5.3 – METABÓLITOS
1. 4-Metilaminoantipirina, é um metabólito ativo (Flusser et al, 1988; Brune, 1988).
2. 4-Aminoantipirina, também é um metabólito ativo (Brune, 1988; Flusser et al, 1988; Volz et Kellner, 1980).
3. 4-Formil-aminoantipirina (4-FAA), é um metabólito inativo (Vlahov et al, 1990; Volz et Kellner, 1980).
4. 4-acetilaminoantipirina (4-AcAA), também é inativo (Vlahov et al, 1990; Volz et Kellner, 1980).
4.5.4 – EXCREÇÃO
4.5.4.1 – Leite Materno
Os metabólitos ativos da dipirona, tanto o 4-MAA, quanto o 4-AA podem ser encontrados em altos níveis no leite materno. Estão em concentração igual ou até maior que no plasma. No entanto, os metabólitos foram encontrados no leite até 48 horas após administração única de dipirona por via oral , devendo o uso de dipirona ser evitado durante o aleitamento materno (Zylber-Katz et al, 1986).
4.5.4.2 – Rins
A excreção renal é intensa, sendo a maior via de eliminação (Vlahov et al, 1990; Volz et Kellner, 1980). Os metabólitos 4-FAA e 4-AcAA são excretados primeiramente na urina (Vlahov et al, 1990; Volz et Kellner, 1980).
4.5.5 – MEIA VIDA
O metabólito 4-MAA tem uma meia vida de 2 a 3 horas (Vlahov et al, 1990; Volz et Kellner, 1980). O tempo de eliminação médio do metabólito 4-MAA é significativamente aumentado nos portadores assintomáticos de hepatite B, quando comparado com indivíduos sadios. (Levy et al, 1997), enquanto o tempo de meia-vida de eliminação do 4-FAA está significativamente diminuido em portadores de hepatite B em comparação com sujeitos não portadores. Os tempos de meia-vida de eliminação dos metabólitos 4-MAA e 4-AcAA não apresentam diferenças estatísticas significantes entre os dois grupos. (Levy et al, 1997).
O metabólito 4-AA tem uma meia-vida de eliminação de 4 a 5 hoas (Vlahov et al, 1990; Volz et Kellner, 1980).
5 – Diluição e Estabilidade
A Dipirona é compatível com solução glicosada a 5%, solução de NaCl a 0,9%
e Ringer lactato*.
A administração deve ser imediata em “bolus” (ou em bolo) já que a estabilidade é limitada nas
três soluções, devendo ser evitada a infusão contínua*.
* Informações do fabricante Aventispharma (fabricante da Novalgina®).
6 – RESTRIÇÕES AO USO
6.1 – CONTRA-INDICAÇÕES
Discrasias sanguíneas ou depressão da medula óssea, hipersensibilidade, rinite, urticária, asma e reações alérgicas à aspirina ou outros agentes antiinflamatórios.
6.2 – PRECAUÇÕES
História de úlceras gastrointestinais, hemorragias gástricas ou perfurações da mucosa; disfuções renais; hipertensão cardíaca (sobrecarga ventricular esquerda) ou disfunções cardíacas agravadas por retenção de fluidos e edema; disfução hepática; infecções pré-existentes; porfíria; deficiencia de glicose-6-fosfato desidrogenase e uso concomitante com clorpormazina.
6.3 – REAÇÕES ADVERSAS
Anemia hemolítica e aplasia de medula óssea tem sido reportada durante o uso de dipirona (Anon, 1986; Sansone et al, 1984; Lay, 1966). Agranulocitose é a ocorrência mais frequente durante a administração de dipirona e pode ser fatal (Arellano et Sacristan, 1990; Hargis et al, 1989; Kiatboonsri et Richter, 1989; Anon, 1986; Gladtke, 1983; Anon, 1973; Bottiger et Westerholm, 1973; Sadusk, 1965; Huguley, 1964), tendo muitos casos acontecidos durante 20 anos de uso de dipirona na Holanda (van der Klauw et al, 1998). A incidência da indução de agranulocitose tem variação geográfica. Aparece em altas frequências em Barcelona e Berlim e em pequnos índices em Budapest, Tel-Aviv e Sofia (Anon, 1986; Arellano et Sacristan, 1990; Anon, 1973; Vlahov et Bacracheva, 1989) e varia de estudo para estudo. Diferenças regionais são muito provavelmente relatadas pela avaliação e uso em modelos em vários países. A incidência de agranulocitose varia em 1,1 por milhão, durante a primeira semana de administração (Anon, 1986) e um caso para cada 3000 usuários (Bottiger et Westerholm, 1973). Calculos baseados em dados levantados, sugerem que o uso da dipirona está associado a menos de 7000 casos por ano no mundo todo (Kiatboonsri et Richter, 1989).
Os efeitos cardiovasculares incluem hipotensão de moderada até severa (Hoigne et al, 1986; Sanahuja et al, 1990). Evidencias de hipotensão com doses orais também tem sido descritas (Giovannini et al, 1986; Paeile et Gallardo, 1974).
Efeitos centrais mais significativos são sonolência, astenia e cefaléia (Lehtonen et al, 1983; Paeile et Gallardo, 1974).
Efeitos gastrointestinais incluem náusea, vômitos, irritação gástrica e xerotomia, que tem sido relatadas com a administração parenteral de dipirona (Marthak et al, 1991; Lehtonen et al, 1983; Paeile et Gallardo, 1974; von Szeged et Michos, 1986).
Broncoespasmo também tem sido descrito em administrações contínuas de dipirona (Arellano et Sacristan, 1990).
Entre as reações cutâneas pode ser encontrado necrose epidermal tóxica, urticária, “rash” cutâneo (Anon, 1973; Arellano et Sacristan, 1990; Pandhi et al, 1984; Pasricha, 1979; Lehtonen et al, 1983; Saban et al, 1991).
Choque anafilático também pode acontecer, com uma incidência de 1 caso em 5000 administrações (Fosseus et Straughan, 1983; Arellano et Sacristan, 1990; Kiatboonsri et Richter, 1988).
6.4 – TERATOGÊNESE
Em estudo controlado, com administração de dipirona via oral durante a gravidez, mostrou que o desenvolvimento de tumor de Wilms foi da ordem de 10,9% (com p<0,05). Esse estudo incluiu 109 casos de tumor de Wilms e 218 controles. A idade significante dos casos ao tempo do diagnóstico foi de 41,1 meses. As mães foram questionadas sobre o uso de medicamentos durante a gravidez para se determinar a correlação do desenvolvimento do tumor e o uso de medicamentos e a dipirona foi a mais utilizada durante a gravidez de mulheres cujos filhos apresentaram o tumor, possivelmente devido a facilidade de acesso à droga. Sem dados de estudos prospectivos, o aumento na indicencia de tumor de Wilms em crianças expostas à dipirona não pode ser atribuida definitivamente ao fármaco, no entanto, baseado nesses estudos o uso de dipirona durante a gravidez deve ser evitado (Sharpe et Franco, 1996).
6.5 – INTERAÇÕES MEDICAMENTOSAS
6.5.1 – ACENOCOUMAROL
Não foram observados efeitos significantes nos tempos de coagulação durante uso concomitante com a dipirona (Zylber-Katz et al, 1985), porém sempre é indicado o máximo de cuidado e monitorização do paciente em uso concomitante de dipirona com anticoagulantes orais, especialmente se houver necessidade da adição de um antiinflamatório não esteróide ao tratamento. O efeito adverso mais comum é o aumento do risco de hemorragias.
6.5.2 – ALENDRONATO
Durante três anos de estudo clínico controlado, envolvendo 2027 pacientes que recebiam antiinflamatórios não esteroidais, a incidência de efeitos adversos gastrointestinais foi similar entre os pacientes recebendo alendronato e pacientes recebendo placebo. No entanto, quando administrado alendronato com AINEs, e dipirona, a incidencia aumentava, especialmente a irritação gástrica, efeito também observado com a dipirona (Prod Info FosamaxÒ , 1999).
6.5.3 – INIBIDORES DA ECA
É conhecida a interação entre os inibidores da ECA e a dipirona, podendo surgir bradicardia, frequentemente induzida por hipercalemia (Shionori, 1993). Esse distúrbio pode levar a paradas cardíacas (Kurata et al, 1999).
6.5.4 – BLOQUEADORES BETA-ADRENÉRGICOS
Em uso concomitante de dipirona com beta-bloqueadores, tem sido reportado aumento na tensão arterial e interferência no controle da pressão sanguínea (Radack et al, 1987; Webster et al, 1984; Abate et al, 1990; Chalmers et al, 1984; Durao et al, 1977; Salvetti et al, 1984; Watkins et al, 1980).
6.5.5 – BLOQUEADORES DE CANAIS DE CÁLCIO
O uso de dipirona com bloqueadores de canais de cálcio (nifedipina), aumenta o risco de hemorragia gastrintestinal (Pahor et al, 1996).
7 – EFICÁCIA COMPARATIVA
7.1 – ACETAMINOFENO (Paracetamol)
7.1.1 – FEBRE
Dipirona na dose de 0,5g oral demonstrou efeitos antipiréticos mais acentuados que o paracetamol na mesma dose em pacientes com febre tifóide e estudo controlado. A redução da temperatura retal foi muito mais significativa com dipirona do que com paracetamol até uma ou duas horas após a administração. Existe uma tendência da dipirona para um efeito prolongado, em torno de 6 horas ou mais (Ajgaonkar et al, 1988).
7.2 – ÁCIDO ACETILSALICÍLICO (Aspirina)
7.2.1 – FEBRE
Em um estudo pequeno, duplo-cego, o efeito de 500mg de dipirona “per-ós” foi superior à mesma dose de ácido acetilsalicílico no tratamento de febre (Reiner et al, 1984).
7.2.2 – DOR PÓS-OPERATÓRIA
O efeito de 500mg de dipirona 500mg “per-ós” é consideravelmente superior ao do ácido acetilsalicílico na mesma dose no tratamento de dor, em estudo controlado (Arellano et Sacristan, 1990).
7.3 – N-METIL-BUTIL-ESCOPOLAMINA (Hioscina)
7.3.1 – NA CÓLICA RENAL
Em estudo controlado com n=96 pacientes com cólica renal, a hioscina em dose 20mg intravenosa foi inefetiva na remissão dos sintomas dolorosos, enquanto a dipirona na dose de 1 grama intravenosa apresentou efeito menor que 2,5 gramas pela mesma via. 61% dos pacientes tratados com hioscina precisaram da adminstração conjunta de analgésicos narcóticos (petidina, nalbufina, tramadol ou morfina) para controlar a dor, enquanto 17% e 0%, respectivamente, dos pacientes em uso de dipirona precisaram da adição de analgésico opióide (Lloret et al, 1987).
7.4 – CLONIXINA
7.4.1 – DOR NA PÓS-HISTERECTOMIA
Em estudo randomizado, duplo-cego com n=160 pacientes divididos em 4 grupos de 40 pacientes cada, foi administrado 30mg em bolus 15 minutos antes da cirurgia e 15mg em bolus de clonixina após a cirurgia, ou 660mg de dipirona em bolus antes e 330mg após a histerectomia. 4,4% das pacientes tratadas com dipirona necessitaram de doses adicionais de dipirina para controlar a dor no pós-operatório contra 11% das pacientes tratadas com clonixina (Rodriguez et al, 1993).
7.5 – DEXTROCETOPROFENO
7.5.1 – DOR NO PÓS-OPERATÓRIO ODONTOLÓGICO
A dipirona é tão eficaz quanto do cetoprofeno em analgesia no pós-operatório odontológico (Bagan et al, 1998).
7.6 – DICLOFENACO
7.6.1 – NA CÓLICA RENAL
injeção intravenosa de 2,5 gramas de dipirona combinada com pitofenona (um espasmolítico semelhante à atropina) e fempiverinium (um espasmolítico homólogo da papaverina) tem efeito similar ao diclofenaco na dose 75mg por via intramuscular. Ou seja, o diclofenaco em monoterapia é mais efetivo que a dipirona em monoterapia (Sanahuja et al, 1990).
7.6.2 – NA CIATALGIA
No tratamento da ciatalgia (dor do nervo ciático), 2,5 gramas de dipirona intramuscular foi mais efetivo que 75 miligramas de diclofenaco pela mesma via em tratamento controlado, randomizado, duplo-cego de 260 pacientes que receberam dipirona, diclofenado ou placebo por via intramuscular. A dipirona foi mais efetiva que o diclofenaco com início do efeito após uma hora da aplicação e prolongando-se por cerca de 48 horas (Babej-Dolle et al, 1994).
7.7 – IBUPROFENO
7.7.1 – NA DOR PÓS-CIRÚRGICA
Em estudo comparado entre dipirona magnesiana intramuscular, ibuprofeno e placebo por via oral, a espectro analgésico e o tempo de duração da ação entre a dipirona e o ibuprofeno foram semelhantes e superiores ao placebo (de Miguel Rivero et al, 1997).
7.8 – INDOMETACINA
7.8.1 – NA CÓLICA RENAL
Injeção intravenosa de 2,5g de dipirona tem mostrado efeito maior que 50mg de indometacina pela mesma via, no tratamento da cólica ureteral em litíases (cálculos) renais (Lehtonen et al, 1983).
7.9 – KETORALAC
7.9.1 – EM ANALGESIA
Em estudo randomizado, comparando aplicação de 30mg de ketorolac por via intramuscular (um AINE derivado da pirazolona) com 2g de dipirona pela mesma via cada 12 horas em n=60 pacientes com dor de severa à moderada após cirurgia ortopédica, encontrou-se uma eficácia similar entre o ketorolac e a dipirona no controle da dor nas primeiras 6 horas do pós-operatório. Após os três dias seguintes, a redução da intensidade da dor foi melhor conseguida com o ketorolac, demonstrando uma eficácia maior deste analgésico em relação à dipirona (Fernandez-Sabate et al, 1991).
7.10 – MEPERIDINA (Petidina)
7.10.1 – NA DOR PÓS-CIRÚRGICA
Dipirona na dose 2,5g intramuscular ou intravenosa tem sido tão efetivo quanto 50 ou 100mg de petidina intravenosa no tratamento da dor pós-cirúrgica (Patel et al, 1980; Lal et al, 1973; Arellano et Sacristan, 1990).
7.10.2 – NA CÓLICA RENAL
Doses de 2,5g de dipirona intravenosa tem se mostrado tão efetivo quanto 50mg de petidina intravenosa no tratamento da cólica renal em cólica ureteral em um estudo randomizado (Lehtonen et al, 1983).
7.11 – NIMESULIDE
7.11.1 – NA FEBRE
Em um pequeno estudo duplo-cego, 500mg de dipirona por via oral foi comparada em eficácia com o nimesulide (um novo AINE) na dose 100mg pela mesma via, no tratamento da febre frequentemente produzida por diversos fatores. Ambas as drogas apresentaram o mesmo escore de efetividade e foram superioras ao ácido acetilsalicílico, que também foi utilizado no estudo, em efeito (Reiner et al, 1984).
7.11.2 – NA DOR PÓS-CIRÚRGICA
Em estudo duplo-cego em crianças com dor pós-operatória foram utilizados supositórios de 100mg de nimesulide e 300mg de dipirona a cada 6 horas e ambas as drogas apresentaram a mesma eficácia no tratamento da dor inflamatório no pós-operatório das crianças (Scharli et al, 1990).
7.12 – PENTAZOCINE
7.12.1 – NA DOR DO PÓS-CIRÚRGICO BUCO-MAXILO-FACIL
Administrações orais de dipirona na dose 300mg e pentazocine na dose 50mg a cada 4 horas mostraram eficácia semelhante em tratamento da dor no pós-cirúrgico de procedimentos bucais, maxilares e faciais, em estudo duplo-cego. Neste estudo encontrou-se efeitos adversos maiores causados pelo pentazocine em relação à dipirona (Paeile et Gallardo, 1974).
7.13 – SUPROFENO
7.13.1 – NEURALGIAS CRÔNICAS
Suprofeno oral na dose 200mg 3 à 4 vezes ao dia foi tão efetivo quanto a dipirona na dose 500mg 3 a 4 vezes ao dia no tratamento de neuralgias cronicas de moderada a severa em estudo controlado envolvendo 60 pacientes hospitalizados (von Szeged et Michos, 1986).
7.14 – TRAMADOL
7.14.1 – NA CÓLICA BILIAR AGUDA
Um estudo multicêntrico e randomizado, um grupo de 74 pacientes com cólica aguda severa de vesícula biliar, induzida por litíase biliar, foram comparados dipirona, 2,5g, hioscina 20mg e tramadol 100mg, todos por via intravenosa. O temp início da redução da dor foi significativamente menor com a dipirona (10,9 minutos), em comparação com o tramadol (15,8 minutos) e hioscina (25,6 minutos). No grupo tratado com dipirona, 3 pacientes necessitaram de doses adicionais da droga após 20 minutos, enquanto no grupo da hioscina 8 pacientes necessitaram de outra dose do fármaco e no grupo tratado com tramadol apenas 1 paciente necessitou de outra dose do analgésico (Schmieder et al, 1993).
7.14.2 – NAS ODONTALGIAS
Tramadol na dose 50mg por via oral e dipirona na dose 100mg pela mesma via foram considerados equipotentes no tratamento da dor de dente em tratamento experimental de dor induzida, em estudo controlado envolvendo 10 indivíduos sadios (Rohdewald et al, 1988).
7.14.3 – NA DOR PÓS-CIRÚRGICA
A eficácia do efeito analgésico do tramado (100mg intramuscular) foi comparado com uma associação de dipirona 500mg com difenidramina 12,5mg, drofenina 25mg e benzetilio 2,5mg, para o tratamento da dor pós-operatória em um estudo controlado, randomizado com 60 pacientes que sofreram cirurgia abdominal. Ambas as drogas foram administradas a cada 8 horas por 3 dias. A intensidade da dor foi reduzida mais efetivamente com tramadol após a primeria dose e durante os três dias de tratamento (p<0,05) e a qualidade do sono dos pacientes foi significativamente melhor com o tramadol do que com a dipirona associada (p<0,001). Efeitos adversos apareceram em 3 pacientes do grupo com tramadol e apenas em um paciente no grupo com dipirona associada (Canepa et al, 1993).
8 – REFERENCIAS BIBLIOGRÁFICAS
- Abate MA, Layne RD, Neely JL et al. Effect of naproxen and sulindac on blood pressure response to atenolol. Drug Intell Clin Pharm 1990; 24:810-813.
- Abate MA, Neely JL, Layne RD et al. Interaction of indomethacin and sulindac with labetolol. Br J Clin Pharmacol 1991; 31:363-366.
- Abbate R, Gori AM, Pinto S et al. Cyclooxygenase and lipoxygenase metabolite synthesis by polymorphonuclear neutrophils: in vitro effect of dipyrone. Prostagl Leukotr Ess Fatty Acids 1990;
41:89-93. - Agar JW. Cyclosporine A and mefenamic acid in a renal transplant patient. Aust N Z J Med 1991; 21:784-785.
- Ahmad S. Indomethacin-enalapril interaction: an alert (letter). South Med J 1991; 84:411-412.
- Ajgaonkar VS, Marathe SN et Virani AR. Dipyrone versus paracetamol: a double-blind study in typhoid fever. J Int Med Res 1988;
16:225-230. - Ajgaonkar VS et Pinto Pereira LM. Patient study of antipyretic drug efficacy. Curr Ther Res 1985; 33:440-445.
- Altman RD, Perez GO et Sfakianakis GN. Interaction of cyclosporine A and nonsteroidal anti-inflammatory drugs on renal function in patients with rheumatoid arthritis. Am J Med 1992; 93:396-402.
- Anon. Comparative study of the efficacy of dipyrone, diclofenac sodium and pethidine in acute renal colic. Eur J Clin Pharmacol 1991; 40:543-546.
- Anon. Dipyrone and aminopyrine – for relief of fever. Med Lett Drugs Ther 1973; 15:4.
- Anon. Dipyrone as a cause of drug rashes: an epidemiologic study. A report from the Boston Collaborative Drug Surveillance Program. Int J Epidemiol 1973a; 2:167-170.
- Anon. Reports prompt new warnings on LMW heparin, heparinoids. Am J Health Syst Pharm 1998; 55:210.
- Anon. Risks of agranulocytosis and aplastic anemia: a first report of their relation to drug use with special reference to analgesics. JAMA 1986; 256:1749-1757.
- ANTONINI, V, MARAMA, N, SERATICUK, J. C. Anuário Estatístico do Serviço de Farmácia Hospitalar – 1999. Curitiba : Serviço de Farmácia Hospitalar do HC-UFPR, 2000.
- Arellano F et Sacristan JÁ. Metamizole: reassessment of its therapeutic role. Eur J Clin Pharmacol 1990; 38:617-619.
- Babej-Dolle R, Freytag S, Eckmeyer J et al. Parenteral dipyrone versus diclofenac and placebo in patients with acute lumbago or sciatic pain: randomized observer-blind multicenter study. Int J Clin Pharmacol Ther Toxicol 1994; 32:204-209.
- Bagan JV, Arranz JSL, Valencia E et al. Clinical comparison of dexketoprofen trometamol and dipyrone in postoperative dental pain. JClin Pharmacol 1998; 38:55S-64S.
- Bagan JV, Lopez Arranz S, Valencia E et al. Clinical comparison of dexketoprofen trometamol and dipyrone in postoperative dental pain. JClin Pharmacol 1998; 38(suppl):55S-64S.
- Bahrt KM, Korman LY et Nashel DJ. Significance of a positive test for occult blood in stools of patients taking anti-inflammatory drugs. Arch Intern Med 1984; 144:2165-2166.
- Bloch B, Smythe E et Weeks R. Analgesics for pain relief after gynaecological surgery. S Afr Med J 1985; 67:325-329.
- Bottiger LE et Westerholm B. Drug-induced blood dyscrasias in Sweden. Br Med J 1973; 3:339-343.
- Branthwaite JP et Nicholls A. Cyclosporine and diclofenac interaction in rheumatoid arthritis (letter). Lancet 1991; 337:252.
- Brenner S, Bialy-Golan A et Crost N. Dipyrone in the induction of pemphigus. J Amer Acad Dermatol 1997; 36:488- 490.
- Brune K. The pharmacological profile of non-opioid (OTC) analgesics: aspirin, paracetamol (acetaminophen), ibuprofen, and phenazones. Agents Actions 1988; 25(suppl):9-19.
- Canepa G, DiSomma C, Ghia M et al. Post-operative analgesia with tramadol: a controlled clinical study compared with analgesic combination. Int J Clin Pharm Res 1993; 13:43-51.
- Cassano WF. Serious methotrexate toxicity caused by interaction with ibuprofen (letter). Am J Pediatr Hematol Oncol 1989; 11:481-482.
- Chalmers JP, West MJ, Wing LM et al. Effects of indomethacin, sulindac, naproxen, aspirin, and paracetamol in treated hypertensive patients. Clin Exp Hypertens 1984; 6:1077-1093.
- Chennavasin P, Seiwell R et Brater DC. Pharmacokinetic-dynamic analysis of the indomethacin-furosemide interaction in man. J Pharmacol Exp Ther 1980; 215:77-81.
- Chlud K et Kaik VB. Clinical studies of the interaction between tolmetin and glibenclamide. Int J Clin Pharmacol 1977; 15:409-410.
- Cohen O, Zylber-Katz E, Caraco Y et al. Cerebrospinal fluid and plasma concentrations of dipyrone metabolites after a single oral dose of dipyrone. Eur J Clin Pharmacol 1998; 54:549-553.
- Collins CL, DeTullio PL, Berardi RR et al. Comparison of home occult blood tests and interaction of tests with ibuprofen. Clin Pharm 1989; 8:501-504.
- Constantopoulos A. Colitis induced by interaction of cyclosporine A and non-steroidal anti-inflammatory drugs. Pediatr Intl 1999; 41:184-186.
- Daly H, Boyle J, Roberts C et al: Interaction between methotrexate and non-steroidal anti-inflammatory drugs. Lancet 1986; 1:559.
- Das UN: Modification of anti-hypertensive action of verapamil by inhibition of endogenous prostaglandin synthesis. Prostaglandins Leukot Med 1982; 9:167-169.
- Davis A, Day RO et Begg EJ: Interactions between non-steroidal anti-inflammatory drugs and antihypertensives and diuretics. Aust N Z J Med 1986; 16:537-546.
- Day RO, Geisslinger G, Paull P et al: The effect of tenoxicam on tolbutamide pharmacokinetics and glucose concentrations in healthy volunteers. Int J Clin Pharmacol Ther 1995; 33:308-310.
- de Miguel Rivero C, Araujo CG, Sousa MM et al: Comparative efficacy of oral ibuprofen-arginine, intramuscular magnetic dipyrone and placebo in patients with postoperative pain following total hip replacement. Clin Drug Invest 1997; 14:276-285.
- Deray G, Le Hoang P, Aupetit B et al: Enhancement of cyclosporine A nephrotoxicity by diclofenac (letter). Clin Nephrol 1987; 27:213-214.
- Dixey JJ, Noormohamed FH, Lant AF et al: The effects of naproxen and sulindac on renal function and their interaction with hydrochlorothiazide and piretanide in man. Br J Clin Pharmacol 1987; 23:55-63.
- Dupuis LL, Shore A, Silverman ED et al: Methotrexate-nonsteroidal antiinflammatory drug interaction in children with arthritis. J Rheumatol 1990; 17:1469-1473.
- Durao V, Prata MM et Goncalves LM: Modification of antihypertensive effect of beta-adrenoreceptor blocking agents by inhibition of endogenous prostaglandin synthesis. Lancet 1977; 2:1005-1007.
- Ebel DL, Rhymer AR, Stahl E et al: Effect of Clinoril (sulindac, MSD), piroxicam and placebo on the hypotensive effect or propranolol in patients with mild to moderate essential hypertension. Scand J Rheumatol 1986; 62(suppl):41S-49S.
- Fairley KF, Woo KT, Birch DF et al: Triamterene-induced crystalluria and cylinduria: clinical and experimental studies. Clin Nephrol 1986; 26:169-173.
- Fauno P, Petersen KD et Husted SE: Increased blood loss after preoperative NSAID. Acta Orthop Scand 1993; 64:522-524.
- Favre L, Glasson P, Riondel A et al: Interaction of diuretics and non-steroidal anti-inflammatory drugs in man. Clin Sci 1983; 64:407-415.
- Favre L, Glasson P et Vallotton MB: Reversible acute renal failure from combined triamterene and indomethacin. Ann Intern Med 1982;
96:317-320. Fernandez-Sabate A, Roca-Burniol J, Roca-Barbera A et al: Ketorolac, a new nonopioid analgesic, in a single-blind trial versus metamizole in orthopedic surgery pain. Curr Ther Res 1991; 49:1016-1024. - Fleming JL, Ahlquist DA, McGill DB et al: Influence of aspirin and ethanol on fecal blood levels as determined by using the HemoQuant assay. Mayo Clin Proc 1987; 62:159-163.
- Flusser D, Zylber-Katz E, Granit L et al: Influence of food on the pharmacokinetics of dipyrone. Eur J Clin Pharmacol 1988; 34:105-107.
- Fosseus CG et Straughan H: Sudden death due to intravenous avapyrazone and dipyrone. S Afr Med J 1983; 64:81.
- Frolich JC, Rupp WA, Zapf RM et al: The effects of metamizol on prostaglandin synthesis in man. Agents Actions Suppl 1986; 19:155-166
- Furst DE: Clinically important interactions of nonsteroidal antiinflammatory drugs with other medications. J Rheumatol Suppl 1988; 17:58-62.
- Furst DE, Herman RA, Koehnke R et al: Effect of aspirin and sulindac on methotrexate clearance. J Pharm Sci 1990; 79:782-786.
- Giovannini M, Longhi R, Besana R et al: Clinical experience and results of treatment with suprofen in pediatrics. 5th communication: a single-blind study on antipyretic effect and tolerability of suprofen syrup versus metamizole drops in pediatric patients. Arzneimittelforschung 1986; 36:959-964.
- Gladtke E: Use of antipyretic analgesics in the pediatric patient. Am J Med 1983; Symposium Nov. 14:121-126.
- Greer IA, Gibson JL, Young A et al: Effect of ketorolac and low-molecular-weight heparing individually and in combination on haemostasis. Blood Coagul Fibrinolysis 1999; 10:367-373.
- Greer IA, Gibson JL, Young A et al: Effect of ketorolac and low-molecular-weight heparin individually and in combination on haemostasis. Blood Coagul Fibrinolysis 1999; 10:367-373.
- Hardy BG, Bartle WR, Myers M et al: Effect of indomethacin on the pharmacokinetics and pharmacodynamics of felodipine. Br J Clin Pharmacol 1986; 26:719-720.
- Hargis JB, LaRussa VF, Redmond J et al: Agranulocytosis associated with “Mexican aspirin” (dipyrone): evidence for an autoimmune mechanism affecting multipotential hematopoietic progenitors. Am J Hematol 1989; 31:213-215.
- Harris KP, Jenkins D et Walls J: Nonsteroidal antiinflammatory drugs and cyclosporine: a potentially serious adverse interaction. Transplantation 1988; 46:598-599.
- Harvey PJ, Wing LM, Beilby J et al: Effect of indomethacin on blood pressure control during treatment with nitrendipine. Blood Press 1995; 4:307-312.
- Heerdink ER, Leufkens HG, Herings RMC et al: NSAIDs associated with increased risk of congestive heart failure in elderly patients taking diuretics. Arch Intern Med 1998; 158:1108-1112.
- Heinemeyer G, Gramm HJ, Roots I et al: The kinetics of metamizol and its metabolites in critical-care patients with acute renal dysfunction. Eur J Clin Pharmacol 1993; 45:445-450.
- Hempel V: Pyrazolones in the treatment of postoperative pain. Agents Actions 1986; 19(suppl):331-337.
- Hoigne R, Zoppi M, Sollberger J et al: Fall in systolic blood pressure due to metamizol (dipyrone, noramidopyrine, novaminsulfone). Agents Actions 1986; 19(auppl):189-195.
- Houston MC, Weir M, Gray J et al: The effects of nonsteroidal anti-inflammatory drugs on blood pressures of patients with hypertension controlled by verapamil. Arch Intern Med 1995; 155:1049-1054.
- Huguley CH: Agranulocytosis induced by dipyrone, a hazardous antipyretic and analgesic. JAMA 1964; 189:938-941.
- Kiatboonsri P et Richter J: Dipyrone trials in Thailand (letter). Lancet 1989; 2:107.
- Kiatboonsri P et Richter J: Unethical trials of dipyrone in Thailand (letter). Lancet 1988; 2:1491.
- Kirchner KA: Role of antidiuretic hormone in the attenuated furosemide response observed during indomethacin administration. J Lab Clin Med 1988; 111:237-243.
- Klassen DK, Jane LH, Young DY et al: Assessment of blood pressure during naproxen therapy in hypertensive patients treated with nicardipine. Am J Hypertens 1995; 8:146-153.
- Koopmans PP, Kateman WG, Tan Y et al: Effects of indomethacin and sulindac on hydrochlorothiazide kinetics. Clin Pharmacol Ther 1985; 37:625-628.
- Koopmans PP, Thien T et Gribnau FWJ: The influence of ibuprofen, diclofenac and sulindac on the blood pressure lowering effect of hydrochlorothiazide. Eur J Clin Pharmacol 1987; 31:553-557.
- Koopmans PP, Thien T, Thomas CM et al: The effects of sulindac and indomethacin on the anti-hypertensive and diuretic action of hydrochlorothiazide in patients with mild to moderate essential hypertension. Br J Clin Pharmacol 1986; 21:417-423.
- Kovarik JM, Kurki P, Mueller E et al: Diclofenac combined with cyclosporine in treatment refractory rheumatoid arthritis: longitudinal safety assessment and evidence of a pharmacokinetic/dynamic interaction. J Rheumatol 1996; 23:2033-2038.
- Kulkarni RD, Bakhle DS, et Pinto Pereira LM: Objective evaluation of antipyretic activity in human volunteers. IRCS Med Sci 1985; 13;148-149.
- Kurata C, Uehara A, Sugi T et al: Syncope caused by nonsteroidal anti-inflammatory drugs and angiotensin-converting enzyme inhibitors. Jpn Circ J 1999; 63:1002-1003.
- Lal A, Pandey K, Chandra P et al: Dipyrone for treatment of post-operative pain. Anaesthesia 1973; 28:43-47.
- Lay WH: Drug-induced haemolytic reactions to antibodies against the erythrocyte/dipyrone complex. Vox Sang 1966; 11:601-610.
- Lehtonen T, Kellokumpu I, Permi J et al: Intravenous indomethacin in the treatment of ureteric colic. Ann Clin Res 1983; 15:197-199.
- Levy M, Leibowich I, Zylber-Katz E et al: Impairment of the metabolism of dipyrone in asymptomatic carriers of the hepatitis B virus. Clin Pharmacol Ther 1997; 62:6-14.
- Levy M: Pharmacokinetics of metamizol metabolites. Agents Actions 1986; 19(suppl):199-204.
- Levy M, Zylber-Katz E et Rosenkranz B: Clinical pharmacokinetics of dipyrone and its metabolites. Clin Pharmacokinet 1995; 28(3):216-234.
- Lloret J, Munoz J, Mommany J et al: Treatment of renal colic with dipyrone. Curr Ther Res 1987; 42:1119-1128.
- Maiche AG: Acute renal failure due to concomitant action of methotrexate and indomethacin (letter). Lancet 1986; 1:1390
- Marthak KV, Gokarn AM, Rao AV et al: A multi-centre comparative study of diclofenac sodium and a dipyrone/spasmolytic combination, and a single-centre comparative study of diclofenac sodium and pethidine in renal colic patients in India. Curr Med Res Opin 1991; 12:366-373.
- Marthak KV, Gokarn AM, Rao AV et al: A multi-centre comparative study of diclofenac sodium and a dipyrone/spasmolytic combination, and single-centre comparative study of diclofenac sodium and pethidine in renal colic patients in India. Curr Med Res Opin 1991; 12:366-373.
- Mathews A et Baillie FR: Acute renal failure and hyperkalaemia associated with triamterene and indomethacin. Vet Hum Toxicol 1986; 28:224-225.
- McCarthy JT, Torres VE, Romero JC et al: Acute intrinsic renal failure induced by indomethacin: role of prostaglandin synthetase inhibition. Mayo Clin Proc 1982; 57:289-296.
- MICROMEDEX, Healthcare Series v. 116. Englewood, Colorado – USA : sept, 2000. (Banco de dados em farmacologia e terapeutica).
- Mills EH, Whitworth JA, Andrews J et al: Non-steroidal anti-inflammatory drugs and blood pressure. Aust N Z J Med 1982; 12:478-482.
- Minuz P, Pancera P, Ribul M et al: Amlodipine and haemodynamic effects of cyclo-oxygenase inhibition. Br J Clin Pharmacol 1995; 39:45-50.
- Morgan T et Anderson A: Interaction of indomethacin with felodipine and enalapril. J Hypertens 1993; 11(suppl 5):338S-339S.
- Mork NL et Robertson RP: Effects of nonsteroidal antiinflammatory drugs in conventional dosage on glucose homeostasis in patients with diabetes. West J Med 1983; 139:46-49.
- Morrison PJ, Rogers HJ, Spector RG et al: Effect of pirprofen on glibenclamide kinetics and response. Br J Clin Pharmacol 1982; 14:123-126.
- Mor R, Pitlik S et Rosenfeld JB: Indomethacin and Moduretic-induced hyperkalemia. Isr J Med Sci 1983; 19:535-537.
- Muck W, Heine PR, Schmage N et al: Steady-state pharmacokinetics of nimodipine during chronic administration of indometacin in elderly healthy volunteers. Arzneimittelforschung 1995; 45:460-462.
- Muck W, Heine PR, Schmage N et al: Steady-state pharmacokinetics of nimodipine during chronic administration of indomethacin in elderly healthy volunteers. Arzneimittelforschung 1995; 45:460-462.
- Nies AS, Gal J, Fadul S et al: Indomethacin-furosemide interaction: the importance of renal blood flow. J Pharmacol Exp Ther 1983; 226:27-32.
- Nies AS: Renal effects of nonsteroidal anti-inflammatory drugs. Agents Actions 1988; 24(suppl):95-106.
- Norfleet RG: 1,300 mg of aspirin daily does not cause positive fecal hemoccult tests. J Clin Gastroenterol 1983; 5:123-125.
- Okonek S: Intoxication with pyrazolones. Br J Clin Pharmacol 1980; 10:385S-390S.
- Okonek S et Reinecke HJ: Acute toxicity of pyrazolones. Am J Med 1983; Symposium Nov 14:94-98.
- Paeile C et Gallardo F: Analgesic activity of pentazocine and dipyrone in ambulatory oral surgery patients. J Oral Surg 1974; 32:191-194.
- Pahor M, Gurainik JM, Furberg CD et al: Risk of gastrointestinal haemorrhage with calcium antagonists in hypertensive persons over 67 years old. Lancet 1996; 347:1061-1065.
- Pancera P, Arosio E, Minuz P et al: Changes in peripheral hemodynamics and vasodilating prostaglandins after high-dose short-term ibuprofen in chronically treated hypertensive patients. Prostaglandins Leukot Essent Fatty Acids 1996; 54:217-222.
- Pandhi RK, Kumar AS, Satish DA et al: Fixed drug eruptions on male genitalia: clinical and etiologic study. Sex Transm Dis 1984; 11:164-166.
- Pasricha JS: Drugs causing fixed eruptions. Br J Dermatol 1979; 100:183-185.
- Patel CV, Koppikar MG, Patel MS et al: Management of pain after abdominal surgery: dipyrone compared with pethidine. Br J Clin Pharmacol 1980; 10:351S-354S.
- Pedrinelli R, Magagna A, Arzilli F et al: Influence of indomethacin on the natriuretic and renal-stimulating effect of bumetanide in essential hypertension. Clin Pharmacol Ther 1980; 28:722-730.
- Peterson MS et al: Differential effects of naproxen and diclofenac on verapamil pharmacokinetics. Clin Pharmacol Ther 1991; 49:129.
- Pilotto A, Leandro G, Franceschi M et al: Antagonism to calcium antagonists. Lancet 1996; 347:1761-1762.
- Polonia J, Boaventura I, Gama G et al: Influence of non-steroidal anti-inflammatory drugs on renal function and 24h ambulatory blood pressure-reducing effects of enalapril and nifedipine gastrointestinal therapeutic system in hypertensive patients. J Hypertens 1995; 13:925-931.
- Pond SM, Birkett DJ et Wade DN: Mechanisms of inhibition of tolbutamide metabolism: phenylbutazone, oxyphenbutazone, sulfaphenazole. Clin Pharmacol Ther 1977; 22:573-579.
- Pond SM, Birkett DJ et Wade DN. Mechanisms of inhibition of tolbutamide metabolism: phenylbutazone, oxyphenbutazone, sulfaphenazole. Clin Pharmacol Ther 1977; 22(5 pt 1):573-579.
- Porterfield WR et Wu CL. Epidural hematoma in an ambulatory surgical patient. J Clin Anesth 1997; 9:74-76.
- Pritchard G, Lyons D, Webster J et al. Do trandolapril and indomethacin influence renal function and renal functional reserve in hypertensive patients. Br J Clin Pharmacol 1997; 44:145-149.
- Product Information: Coumadin(R), warfarin sodium. DuPont Pharma, Wilmington, DE, 1999.
- Product Information: Floxin(R), ofloxacin. Ortho Pharmaceutical Corporation, Raritan, NJ, 1995.
- Product Information: Fosamax(R), alendronate sodium. Merck et Co., Inc., West Point, PA, 1999.
- Product Information. Integrilin(R), eptifibatide. Key Pharmaceuticals, Inc., Kenilworth, NJ, 1999.
- Product Information. Lovenox(R), enoxaparin sodium. Rhone-Poulenc Rorer Pharmaceuticals Inc., Collegeville, PA, 1999.
- Product Information. Naprelan(TM), naproxen sodium. Wyeth-Ayerst Laboratories, Philadelphia, PA, 1996.
- Product Information. Orgaran(TM), danaparoid sodium injection. Organan Inc., West Orange, NJ, 1998.
- Product Information. Toradol(R), ketorolac tromethamine. Roche Laboratories Inc., Nutley, NJ, 1996.
- Product Information. Voltaren(R), diclofenac sodium. Novartis Pharmaceuticals Corporation, East Hanover, NJ, 1996.
- Pye G, Ballantyne KC, Armitage NC et al. Influence of non-steroidal anti-inflammatory drugs on the outcome of faecal occult blood tests in screening for colorectal cancer. Br Med J 1987; 294:1510-1511.
- Radack KL, Deck CC et Bloomfield SS. Ibuprofen interferes with the efficacy of antihypertensive drugs. A randomized, double-blind, placebo-controlled trial of ibuprofen compared with acetaminophen. Ann Intern Med 1987; 107:628-635.
- Ragheb M, Ban TA, Buchanan D et al. Interaction of indomethacin and ibuprofen with lithium in manic patients under a steady-state lithium level. J Clin Psychiatry 1980; 41:397-398.
- Rapeport WG, Grimwood VC, Hosie J et al: The effect of tenidap on the anti-hypertensive efficacy of ACE inhibitors in patients treated for mild to moderate hypertension. Br J Clin Pharmacol 1995; 39(suppl):57S-61S.
- Rapeport WG, Grimwood VC, Korlipara K et al. The effect of tenidap on the anti-hypertensive efficacy of thiazide diuretics in patients treated for mild to moderate hypertension. Br J Clin Pharmacol 1995; 39(suppl1):51S-55S.
- Ravic M, Johnston A et Turner P. Clinical pharmacological studies of some possible interactions of lornoxicam with other drugs. Postgrad Med J 1990; 66(suppl 4):S30-S34.
- Reiner M, Massera E et Magni E. Nimesulide in the treatment of fever: a double-blind crossover clinical trial. J Int Med Res 1984; 12:102-107.
- Reynolds JEF (ed). Martindale: The Extra Pharmacopoeia (electronic version). Micromedex, Inc, Denver, CO, 1992.
- Ribera A, Monasterio J, Acebedo G et al. Dipyrone-induced immune haemolytic anaemia. Vox Sang 1981; 41:32-35.
- Rodriguez M, Barutell C, Rull M et al. Efficacy and tolerance of oral dipyrone versus oral morphine for cancer pain. Eur J Cancer 1994; 30A(5):584-587.
- Rodriguez MJ, de la Torre MR, Perez-Iraola P et al. Comparative study of tramadol versus NSAIDs as intravenous continuous infusion for managing postoperative pain. Curr Ther Res 1993; 54:375-383.
- Rohdewald P, Granitzki HW et Neddermann E. Comparison of the analgesic efficacy of metamizole and tramadol in experimental pain. Pharmacology 1988; 37:209-217.
- Roots I, Kampf D, Heinemeyer G et al. Changes in metamizol kinetics and metabolism during chronic and acute renal failure as compared to healthy volunteers. Arch Pharmacol 1985; 330(suppl):R81.
- Ryan JR, Jain AK, McMahon G et al. On the question of an interaction between sulindac and tolbutamide in the control of diabetes. Clin Pharmacol Ther 1977; 21:231-233.
- Saban J, Pais JR, Rodriguez JL et al. Sjogren-like pluriglandular exocrine insufficiency after drug-induced toxic epidermal necrolysis. Postgrad Med J 1991; 67:195-197.
- Sadusk JF. The relationship of the Food and Drug Administration to the practice of medicine and the aminopyrine-dipyrone problem. South Med J 1965; 58:1508-1512.
- Salvetti A, Arzilli F, Pedrinelli R et al. Interaction between oxprenolol and indomethacin on blood pressure in essential hypertensive patients. Eur J Clin Pharmacol 1982; 22:197-201.
- Salvetti A, Pedrinelli R, Alberici P et al. The influence of indomethacin and sulindac on some pharmacological actions of atenolol in hypertensive patients. Br J Clin Pharmacol 1984; 17(suppl):108S-111S.
- Sanahuja J, Corbera G, Garau J et al. Intramuscular diclofenac sodium versus intravenous Baralgin in the treatment of renal colic. DICP 1990; 24:361-364.
- Sanahuja J, Corbera G, Garau J et al. Intramuscular diclofenac sodium versus intravenous Baralgin in the treatment of renal colic. DICP Ann Pharmacother 1990; 24:361-364.
- Sansone G, Reali S, Sansone R et al. Acute hemolytic anemia induced by a pyrazolonic drug in a child with glucose-6-phosphate dehydrogenase deficiency. Acta Haematol 1984; 72:285-287.
- Scharli AF, Brulhart K et Monti T. Pharmacokinetics and therapeutic study with nimesulide suppositories in children with post-operative pain and inflammation. J Int Med Res 1990; 18:315-321.
- Schmieder G, Stankov G, Zerle G et al. Observer-blind study with metamizole versus tramadol and butylscopolamine in acute biliary colic pain. Arzneimittelforschung 1993; 43:1216-1221.
- Schulz E, Koch K et Schmidt FH. Ursachen der potenzierung der hypoglykamischen wirkung von sulfonylharnstoff derivaten durch medikamente: II. Pharmakokinetik und metabolismus von glibenclamid (HB 419) in gegenwart von phenylbutazon. Eur J Clin Pharmacol 1971; 4:32-37.
- Schuna AA, Vejraska BD, Hiatt JG et al. Lack of interaction between sulindac or naproxen and propranolol in hypertensive patients. J Clin Pharmacol 1989; 29:524-528.
- Seltzer HS. Drug induced hypoglycemia. Endocrinol Metab Clin North Am 1989; 18:163-183.
- Shah SJ, Bhadnardar SD et Satoskar RS. Drug interaction between chlorpropamide and nonsteroidal anti-inflamatory drugs, ibuprofen and phenylbutazone. Int J Clin Pharmacol Ther Toxicol 1984; 22:470-472.
- Sharpe CR et Franco EL. Use of dipyrone during pregnancy and risk of Wilms’ tumor. Epidemiol 1996; 7:533-535.
- Sheiner PA, Mor E, Chodoff L et al. Acute renal failure associated with the use of ibuprofen in two liver transplant recipients on FK506. Transplantation 1994; 57:1132-1133.
- Shinar E et Hershko C. Causes of agranulocytosis in a hospital population: identification of dipyrone as an important causative agent. Israel J Med Sci 1983; 19:225-229.
- Shionoiri H. Pharmacokinetic drug interactions with ACE inhibitors. Clin Pharmacokinet 1993; 25:20-58.
- Singh RR, Malaviya AN, Pandey JN et al. Fatal interaction between methotrexate and naproxen (letter). Lancet 1986; 1:1390.
- Skeith KJ, Russell AS, Jamali F et al. Lack of significant interaction between low dose methotrexate and ibuprofen or flurbiprofen in patients with arthritis. J Rheumatol 1990; 17:1008-1010.
- Slavetti A, Pedrinelli R, Magagna A et al. Calcium antagonists: interactions in hypertension. Am J Nephrol 1986; 6(suppl 1):95-99.
- Sommers DK, Kovarik JM, Meyer EC et al. Effects of diclofenac on isradipine pharmacokinetics and platelet aggregation in volunteers. Eur J Clin Pharmacol 1993; 44:391-393.
- Stewart CF, Fleming RA, Arkin CR et al. Coadministration of naproxen and low-dose methotrexate in patients with rheumatoid arthritis. Clin Pharmacol Ther 1990; 47:540-546.
- Stewart CF, Fleming RA, Germain BF et al. Aspirin alters methotrexate disposition in rheumatoid arthritis patients. Arthritis Rheum 1991; 34:1514-1520.
- Sturrock NDC, Lang CC et Struthers AD. Indomethacin and cyclosporin together produce marked renal vasoconstriction in humans. J Hypertens 1994; 12:919-924.
- Sturrock ND et Struthers AD. Non-steroidal anti-inflammatory drugs and angiotensive converting enzyme inhibitors: a commonly prescribed combination with variable effects on renal function. Br J Clin Pharmacol 1993; 35:343-348.
- Tempel G, von Hundelshausen B et Reeker W. The opiate-sparing effect of dipyrone in post-operative pain therapy with morphine using a patient-controlled analgesic system. Intensive Care Med 1996; 22:1043-1047.
- Tempero KF, Cirillo VJ et Steelman SL. Diflunisal: a review of pharmacokinetic and pharmacodynamic properties, drug interactions, and special tolerability studies in humans. Br J Clin Pharmacol 1977; 4(suppl 1):31S-36S.
- Thyss A, Milano G, Kubar J et al. Clinical and pharmacokinetic evidence of a life-threatening interaction between methotrexate and ketoprofen. Lancet 1986; 1:256-258.
- Tigerstedt I, Leander P et Tammisto T. Postoperative analgesics for superficial surgery: comparison of four analgesics. Acta Anaesth Scand 1981; 25:543-547.
- Todd PA et Sorkin EM. Diclofenac: a reappraisal. Drugs 1988; 35:244-285.
- Tracy TS, Worster T, Bradley JD et al: Methotrexate disposition following concomitant administration of ketoprofen, piroxicam and flurbiprofen in patients with rheumatoid arthritis. Br J Clin Pharmacol 1994; 37:453-456.
- TRISSEL, Lawrence A. Handbook on injectable drugs. 10 ed. Houston, TX-USA: ASHP 1998.
- Tugwell P, Ludwin D, Gent M et al. Interaction between cyclosporin A and nonsteroidal antiinflammatory drugs. J Rheumatol 1997; 24:1122-1125.
- van der Klauw MM, Wilson JHP et Stricker BHC. Drug-associated agranulocytosis: 20 years of reporting in the netherlands (1974-1994). Am J Hematol 1998; 57:206-211.
- Vlahov V, Badian M, Verho M et al. Pharmacokinetics of metamizol metabolites in healthy subjects after a single oral dose of metamizol sodium. Eur J Clin Pharmacol 1990; 38:61-65.
- Volz M et Kellner HM. Kinetics and metabolism of pyrazolones (propyphenazone, aminopyrine and dipyrone). Br J Clin Pharmacol 1980; 10:299S-308S.
- von Szeged AV et Michos N. Controlled single-blind clinical study of suprofen syrup versus metamizole syrup. Arzneimittelforschung 1986; 36:1110-1112.
- Walbridge DG et Bazire SR. An interaction between lithium carbonate and piroxicam presenting as lithium toxicity. Br J Psychiatry 1985; 145:206-207.
- Watkins J, Abbott EC, Hensby CN et al. Attenuation of hypotensive effect of propranolol and thiazide diuretics by indomethacin. Br Med J 1980; 281:702-705.
- Weale AE, Warwick DJ, Durant N et al. Is there a clinical interaction between low molecular weight heparin and non-steroidal analgesics after total hip replacement? Ann R Coll Surg Engl 1995; 77:35-37.
- Webster J, Petrie JC, McLean I et al. Flurbiprofen interaction with single doses of atenolol and propranolol. Br J Clin Pharmacol 1984; 18:861-866.
- Weinberg MS, Quigg RJ, Salant DJ et al. Anuric renal failure precipitated by indomethacin and triamterene. Nephron 1985; 40:216-218.
- Whiting B, Williams RL, Lorenzi M et al. Effect of naproxen on glucose metabolism and tolbutamide kinetics and dynamics in maturity onset diabetes. Br J Clin Pharmacol 1981; 11:295-302.
- Williams RL, Davies RO, Berman RS et al. Hydrochlorothiazide pharmacokinetics and pharmacologic effect: the influence of indomethacin. J Clin Pharmacol 1982; 22:32-41.
- Wong DG, Spence JD, Lamki L et al. Effect of non-steroidal anti-inflammatory drugs on control of hypertension by beta-blockers and diuretics. Lancet 1986; 1:997-1001.
- Wright JT, McKenney JM, Lehany AM et al. The effect of high-dose short-term ibuprofen on antihypertensive control with hydrochlorothiazide. Clin Pharmacol Ther 1989; 46:440-444.
- Zylber-Katz E, Granit L et Levy M. Plasma protein binding of dipyrone metabolites in man. Eur J Clin Pharmacol 1985; 29:67-71.
- Zylber-Katz E, Linder N, Granit L et al. Excretion of dipyrone metabolites in human breast milk. Eur J Clin Pharmacol 1986; 30:359-361.
[Voltar]
Colesterol: a verdade sobre um falso vilão
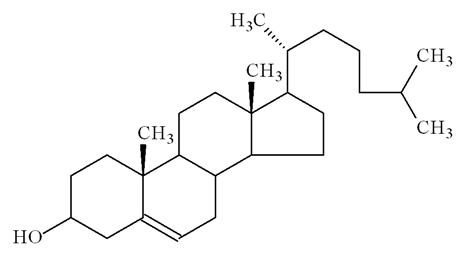
O ciclopentano peridro-fenantreno, ou colesterol, eleito pela mídia jornalística, televisiva e também pelos fabricantes de margarina como o inimigo público número um, na verdade é uma das mais importantes moléculas do organismo humano.
“O colesterol é a pequena partícula que recebeu mais atenção na biologia. Treze prêmios Nobel foram dados a cientistas que dedicaram grande parte de suas carreiras ao colesterol. Desde que foi isolado de cálculos biliares em 1784, tem exercido uma fascinação quase hipnótica em cientistas das mais diversas áreas da ciência e da medicina…
O colesterol é uma molécula com face de Janus. A mesma propriedade que o torna útil nas membranas celulares, sua absoluta insolubilidade em água, também o torna letal.” (BROWN, M. S.; GOLDSTEIN, J. L., 1985).
O colesterol foi eleito pela mídia jornalística como o grande vilão do final do segundo milênio e, como é uma molécula orgânica de poucos Angstrons de tamanho, não pode se “defender” e muito menos tem o direito de resposta, jamais podendo listar, ele próprio, suas utilidades e seus benefícios. Não lhe é dado sequer a prerrogativa de mostrar sua importância e sua indispensabilidade no curso normal da evolução do corpo humano, desde o nascimento até a senilidade. Não pode dizer a ninguém que é o principal responsável pela manutenção da estabilidade estrutural da membrana do eritrócito. Não pode atestar, com absoluta justiça, que é a partir dele – colesterol, que o organismo sintetiza hormônios esteróides importantíssimos ao funcionamento e regulação do metabolismo, os glicocorticóides (cortisol) e os hormônios sexuais indispensáveis a diferenciação sexual secundária e também às funções sexuais humanas (ereção do pênis, ovocitulação, libido, e etc.). Enfim, essa é a molécula mais injustiçada de todos os tempos.
Porque o colesterol foi eleito vilão?
Ao bem da verdade, o colesterol tem seu lado perigoso, mas só afeta as pessoas sedentárias, de vida desregrada. O libelo acusatório veemente de sua letalidade interessa diretamente à indústria alimentícia, mais especificamente aos fabricantes de margarinas e maioneses industrializadas que semeiam pânico entre os espectadores leigos através de uma mentira absurda e conseguem vender seus produtos alegando que eles são isentos de colesterol. Também interessa a muitos médicos, em especial aos cardiologistas e também a muitos pseudo-cientistas, pessoas de inteligência rara, cultura mediana e ignorância profunda, que só querem se aparecer e lançam na televisão, jornais, revistas, folhetos e outros, matérias sem um mínimo de critério cientifico com o único fito de se lançarem e/ou valorizarem suas “carreiras”.
Objetivo desse artigo:
Mostrar aos interessados que o colesterol não é o vilão que a industria procura demonstrar e que ao par dos perigos que pode trazer para os “folgados de plantão”, ele é uma das moléculas mais importantes do organismo humano e sua “carência” pode ocasionar mais prejuízos do que benefícios e estes vão desde hemopatias (distúrbios no sangue), disfunções sexuais das mais variadas, até sérios problemas de metabolismo e regulação homeostáticas.
- Síntese do colesterol
- Síntese da aldosterona
- Síntese da Vitamina D
- Síntese do cortisol
- Síntese dos hormônios sexuais
- Métodos de dosagens, valores de referência e patologias associadas
Referências
BROWN, M. S.; GOLDSTEIN, J. L. A Receptor-mediated pathway for cholesterol homeostasis. Nobel Lecture. NobelPrize.org. Nobel Prize Outreach AB 1998.<https://www.nobelprize.org/prizes/medicine/1985/brown/lecture/>Acesso em: 5/9/1998
Publicado originalmente em dezembro de 1998.
[Voltar]
O primeiro psiquiatra brasileiro
Juliano Moreira (1872-1933), é considerado o primeiro psiquiatra brasileiro. Continue lendo
Biografia do Duque de Caxias
Instituições Medievais: Feudalismo
Na Idade Média, à medida que se formavam os reinos “bárbaros” sobre as ruínas do Império Romano, pouco a pouco se modificaram as instituições políticas, econômicas e sociais. Já pelo século X estava enraizado o Feudalismo, que foi sem dúvida a mais marcante das instituições medievais. Continue lendo
