Papanicolaou (1954) introduziu o termo “discariose” para descrever células apresentando anormalidades nucleares as quais variam de alterações leves para lesões apresentando suspeita de invasão. Após um intervalo no qual a terminologia tornou-se confusa por causa da variação entre laboratórios, um grupo de trabalho da Sociedade Britânica de Citologia Clínica (Spriggs et al., 1978) recomendou um retorno ao uso de “discariótica” para descrever células descamadas de lesões variando de NIC I (displasia leve) para lesões apresentando suspeita de invasão. Foi recomendado que o termo “célula maligna” poderia ser usado somente quando o esfregaço apresentasse diagnóstico característico de invasão. Em 1986 um grupo de trabalho da Sociedade Britânica de Citologia Clínica (Evans et al., 1976) ampliou as recomendações de 1978, mas manteve o uso do termo discariose. Para anormalidades não equivalentes à discariose, foi estabelecido que o termo “alterações borderline” seria usado.
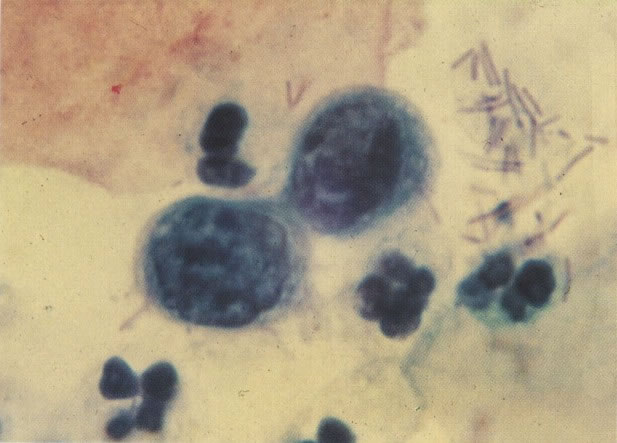
Os núcleos de células discarióticas são hipercromáticos e tem, pelo menos, duas vezes o tamanho do núcleo de uma célula intermediária normal. A cromatina nuclear apresenta condensação granular, mas sem a irregularidade acentuada de áreas claras e condensadas que é vista nos núcleos malignos. Os núcleos são comumente regulares na forma, mas aspectos bizarros podem ocorrer. Diferenciação citoplasmática indica o nível de diferenciação na superfície do epitélio do qual a célula foi esfoliada.
A tabela abaixo mostra uma aproximação da lesão histológica esperada, dependendo das células anormais vistas no esfregaço (clique sobre a imagem para ampliar):
| Tipo celular predominante |
Discariose |
Histologia esperada |
| Célula discariótica madura |
Leve |
NIC I (displasia leve) |
| Célula discariótica intermadiária pequena e parabasal |
Moderada |
NIC II (displasia moderada) |
| Célula discariótica indiferenciada |
Severa |
NIC III ( displasia severa, carcinoma in situ, ? Invasivo |
Esta é uma simplificação, tanto que outros fatores necessitam ser considerados particularmente no diagnóstico da NIC III.
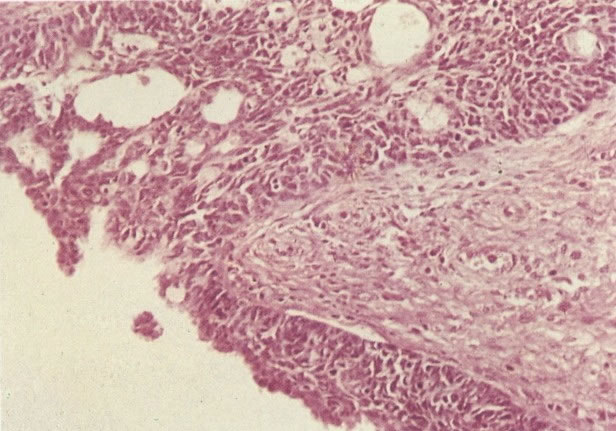
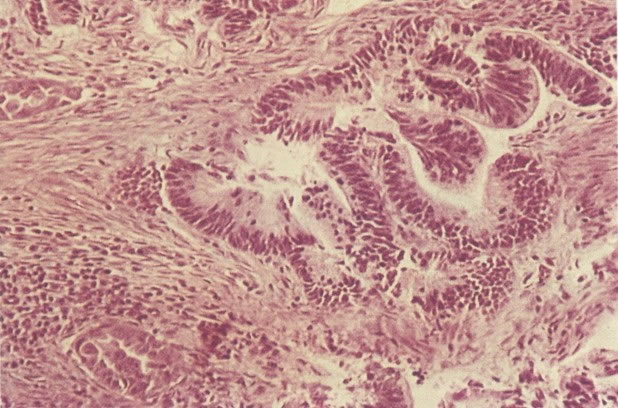
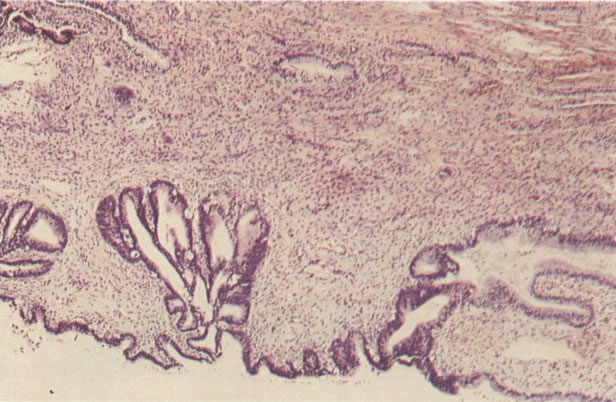
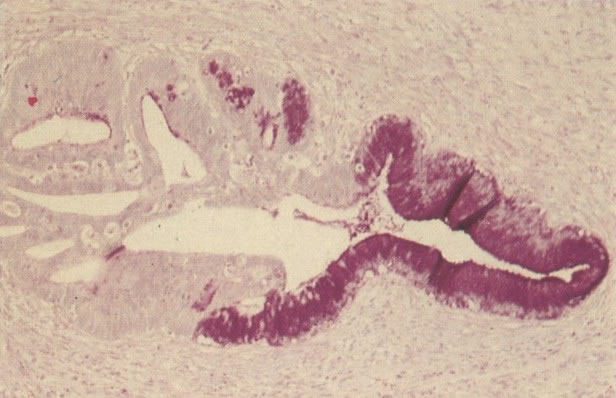
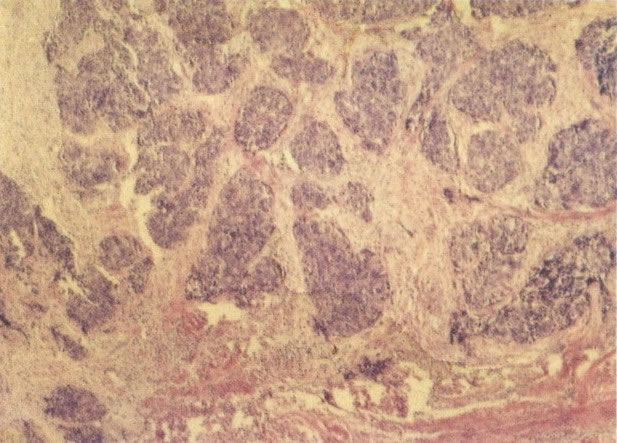
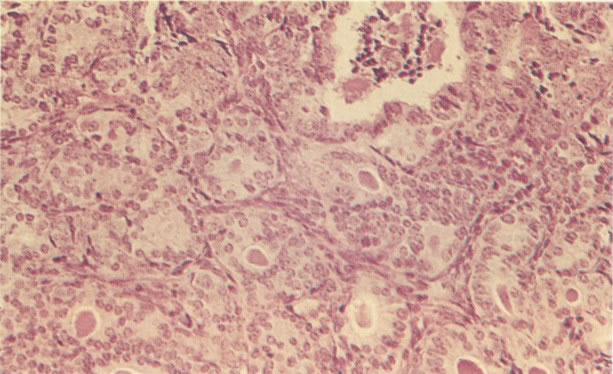
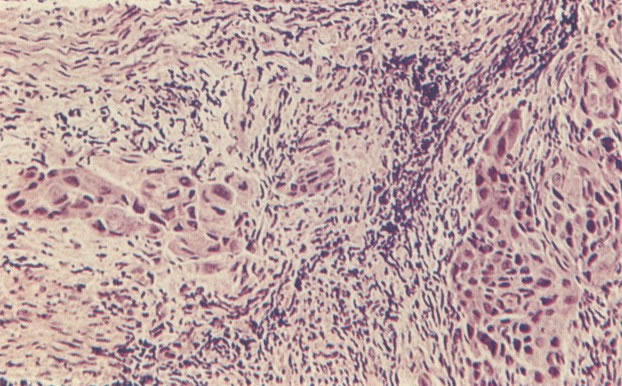
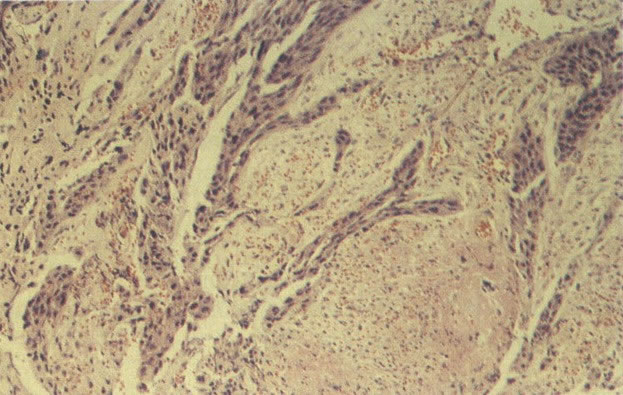
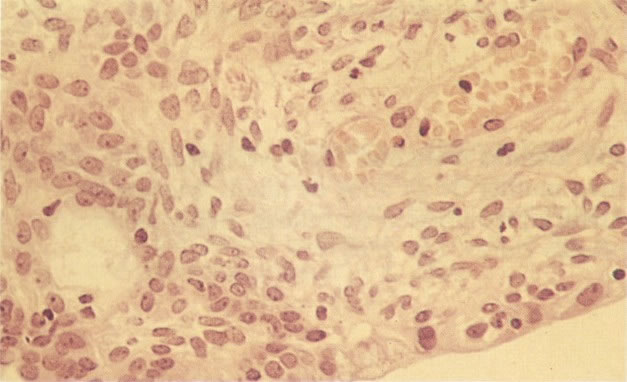
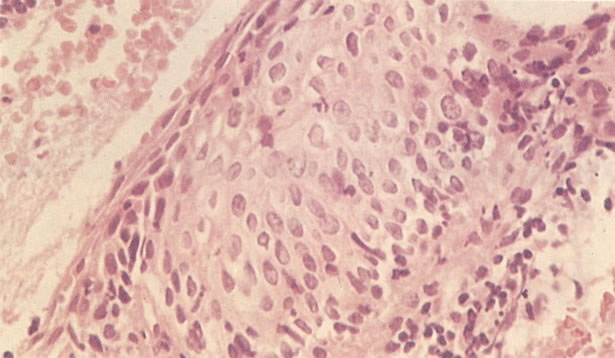
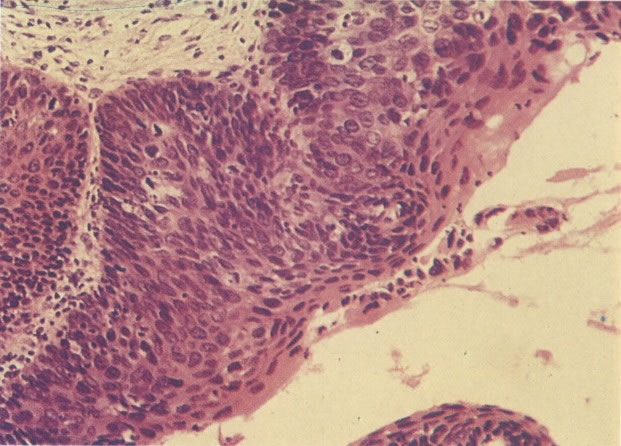
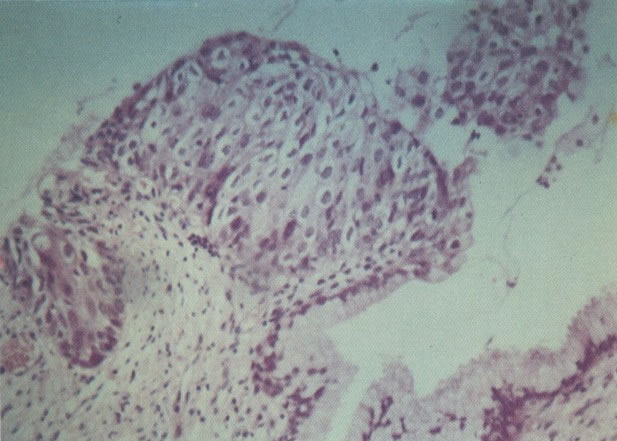
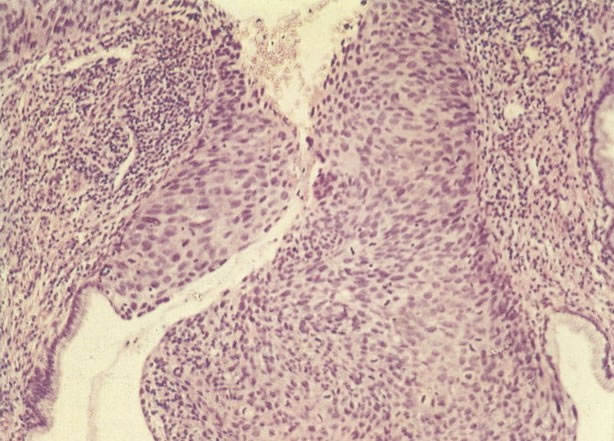
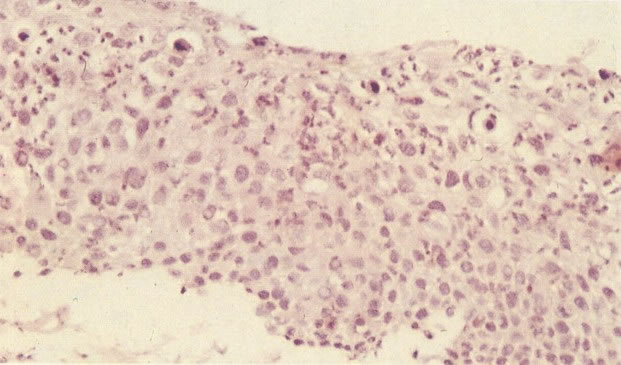
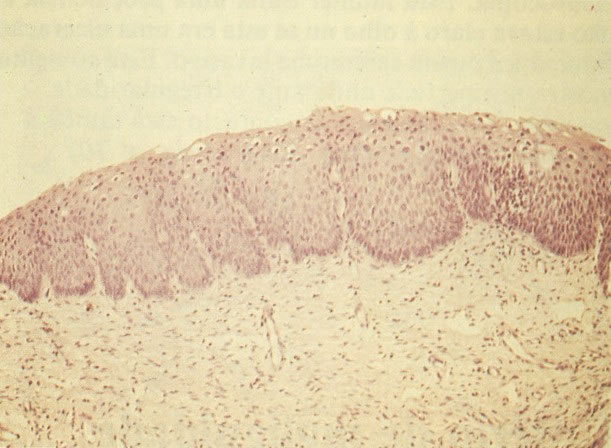
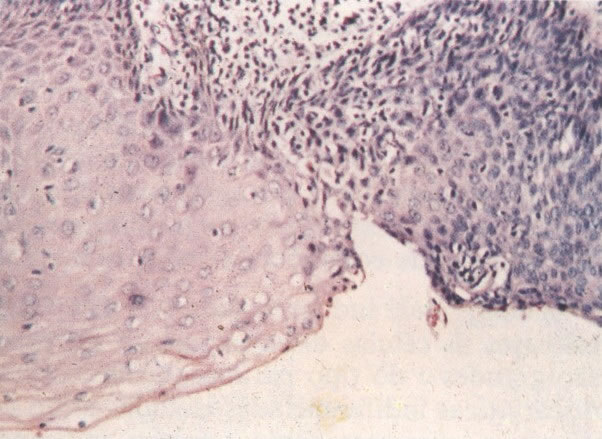
O diagnóstico histológico do NIC III é feito na presença de três padrões epiteliais (Buckley et al., 1982).
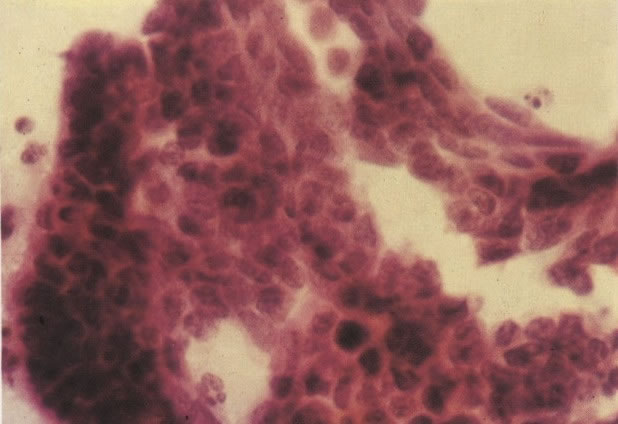
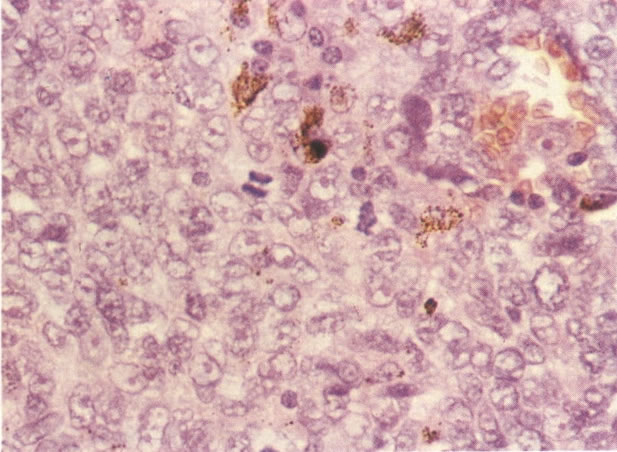
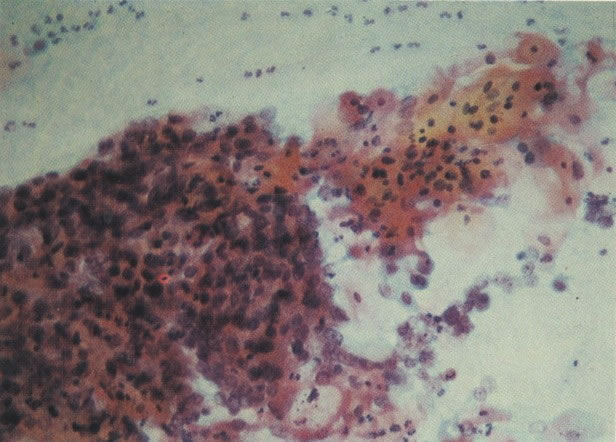
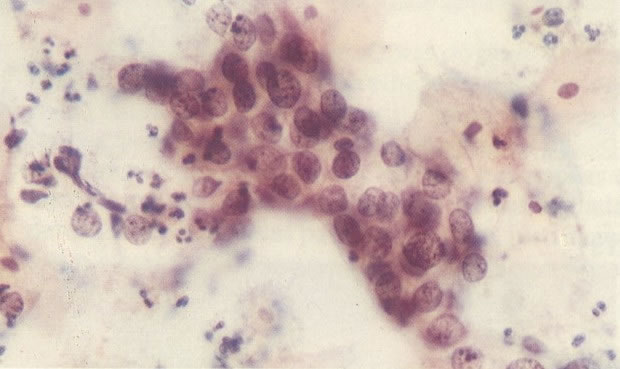
1. Célula pequena indiferenciada (ver 155). Em esfregaços de tais lesões, há um quadro clássico de células discarióticas, pequenas, indiferenciadas, descamadas isoladamente, em grupos frouxos, lâminas coerentes e grupos firmes. Em muitos casos haveria um indício de clareamento do núcleo e esmaecimento da membrana celular; deste modo que o esfregaço teria que ser referido como borderline para invasão.
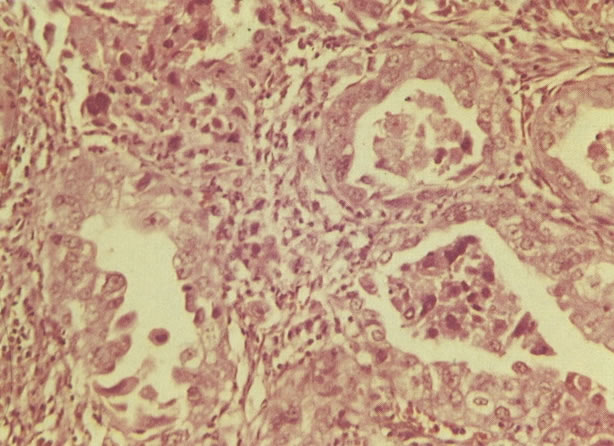
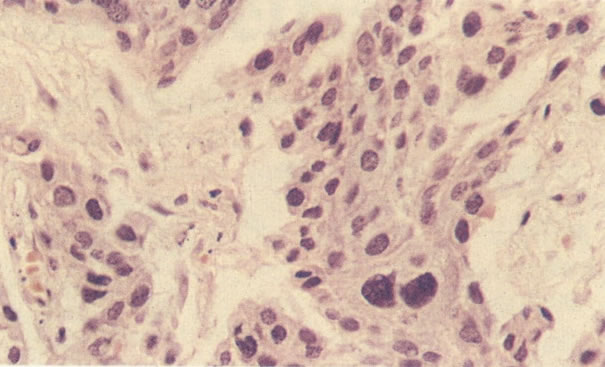
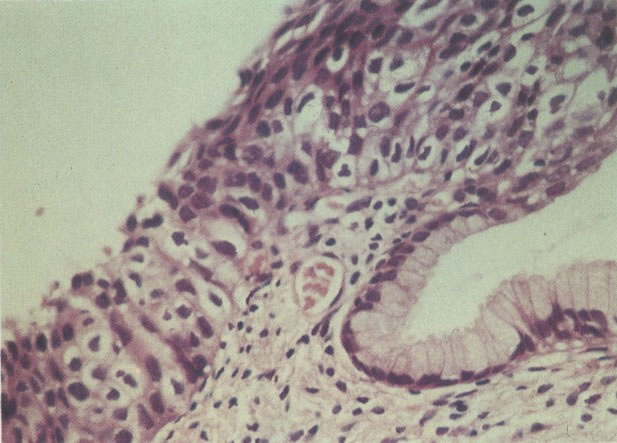
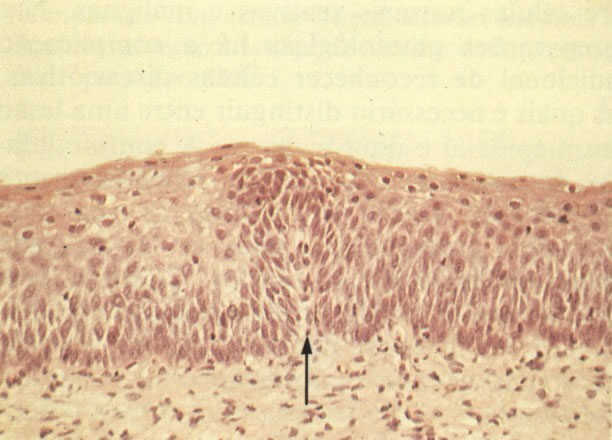
2. Célula grande indiferenciada (ver 175). Nestes casos as células discarióticas no esfregaço são grandes e do tipo parabasal, mas células discarióticas indiferenciadas isoladas estão comumente presentes como também indicando uma lesão mais severa que NIC II (ver tabela). As células parabasais discarióticas podem ser vistas como células isoladas e como lâminas sinciciais e grupos com bordas celulares indistintos. Pode ser necessário referir ao esfregaço como sugestivo de NIC II/III.
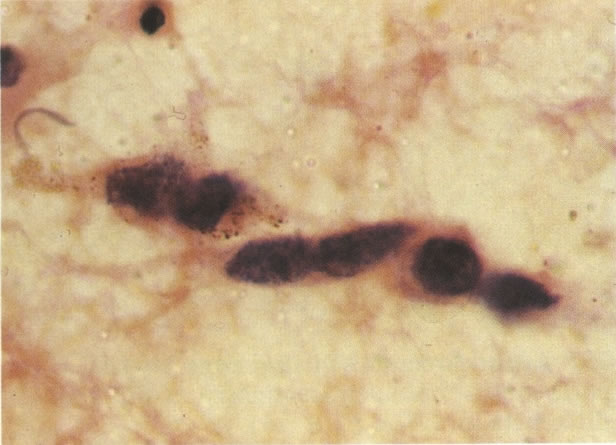
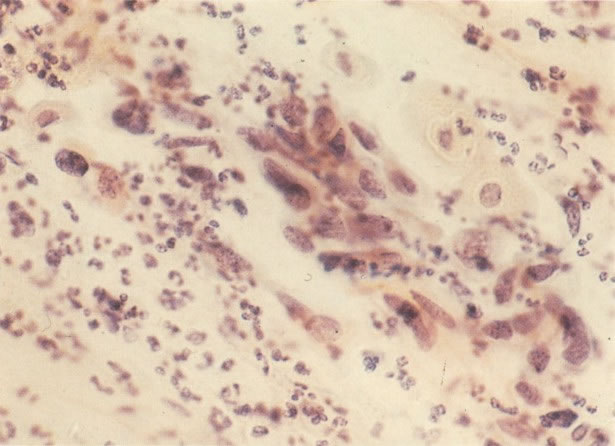
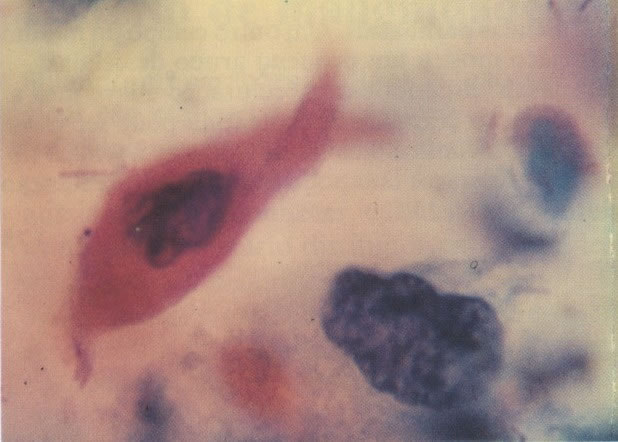
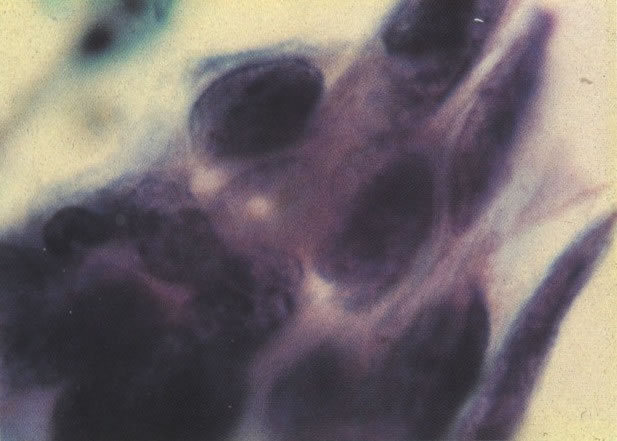
3. Diferenciada (célula grande queratinizada) (ver 178). Cortes de tecido mostram completa desorganização do padrão de crescimento e as células têm uma relação nucleocitoplasmática relativamente baixa; a queratinização e queratose na superfície são comuns. No esfregaço cervical, muitas células se apresentarão como células discarióticas bem diferenciadas, mas a anormalidade nuclear será mais severa que a vista em NIC I. Além disso, células discarióticas indiferenciadas isoladas são anormalmente encontradas. Diferenciação citoplasmática anormal trazendo a forma de “células em fibra”, “células em girino” e outras formas bizarras estão freqüentemente presentes, e quando há degeneração nuclear, o quadro celular pode vir dentro da categoria “borderline para invasão”.
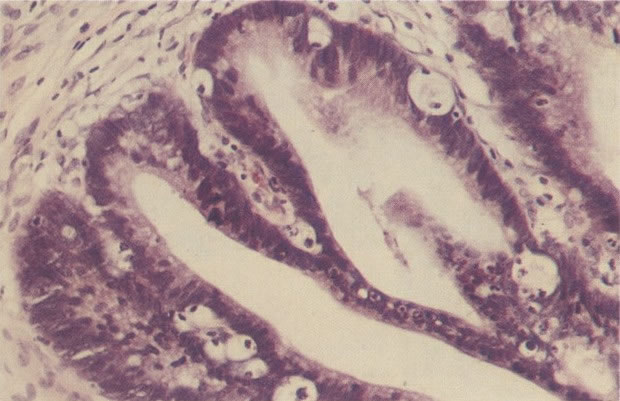
Embora os núcleos de células discarióticas sejam normalmente hipercromáticos em alguns casos, particularmente nos casos de NIC III (células pequenas e grandes), a cromatina nuclear pode ser de coloração clara, mas é habitualmente possível reconhecer a granulação grosseira do padrão de cromatina. Problemas também surgem quando células colunares endocervicais discarióticas estão presentes, sobrepondo-se ao tecido, o qual, será referido como NIC III, no corte histológico.
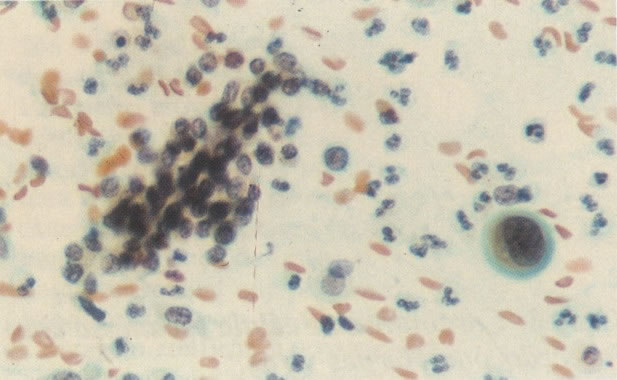
As figuras desta seção ilustram a variação ampla do padrão celular vista na presença de NIC.
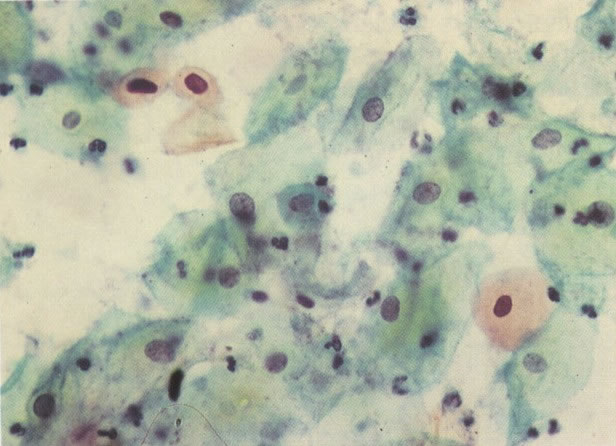
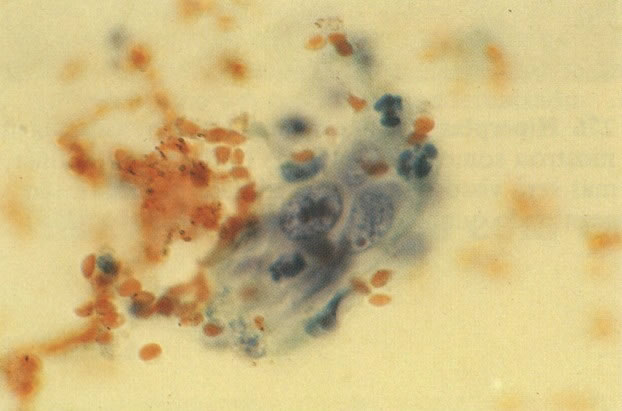
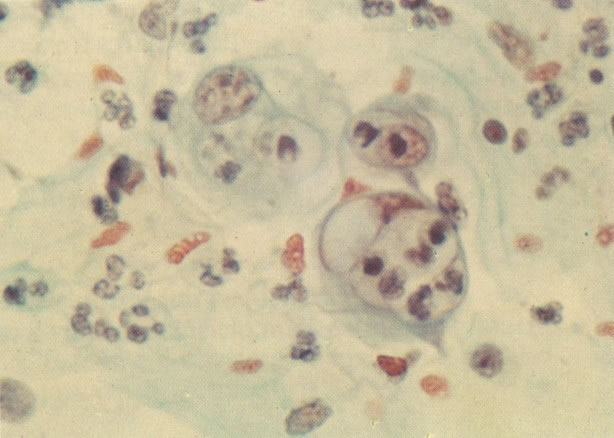
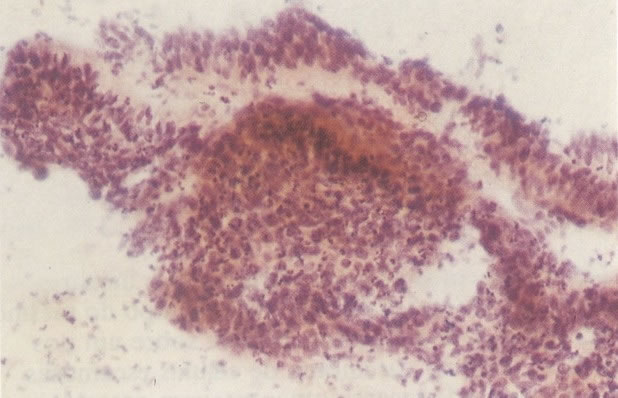
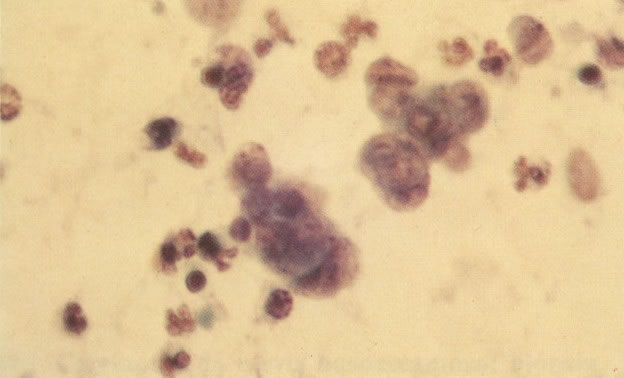
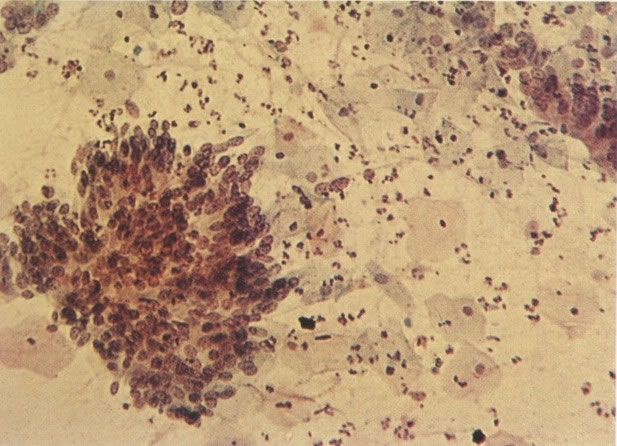
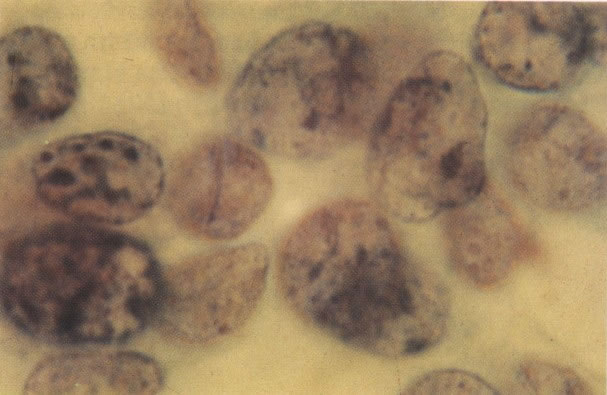
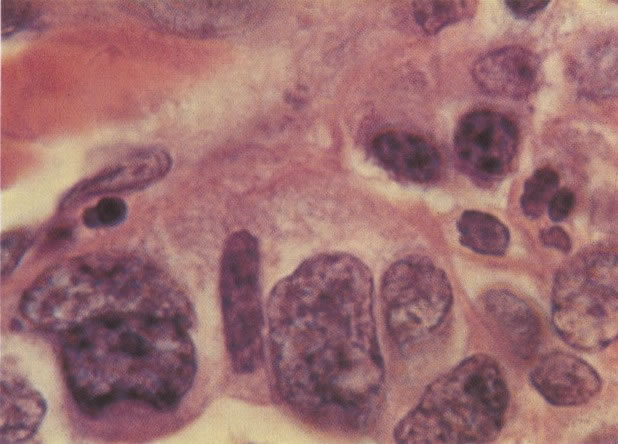
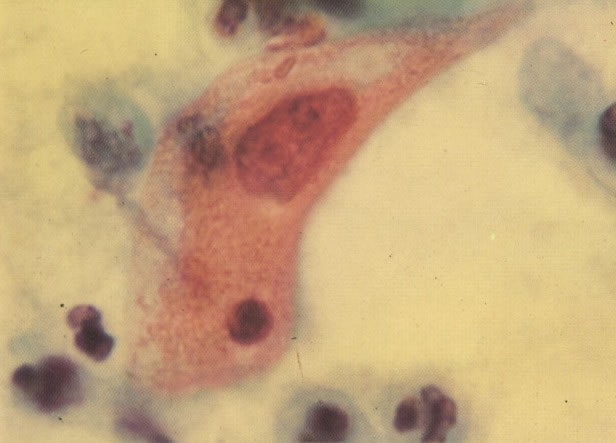
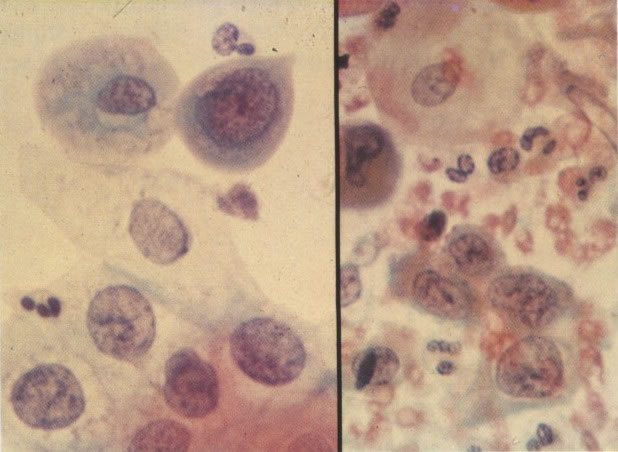
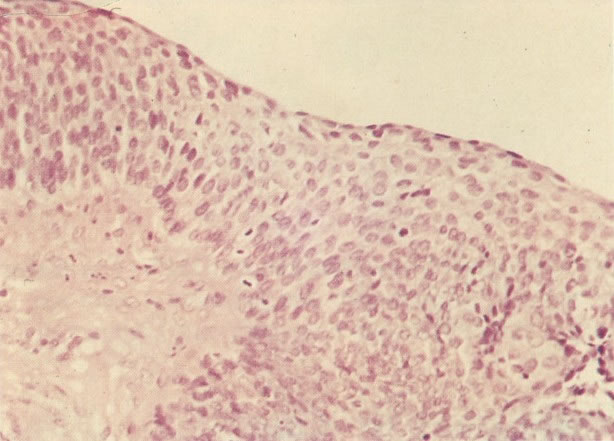
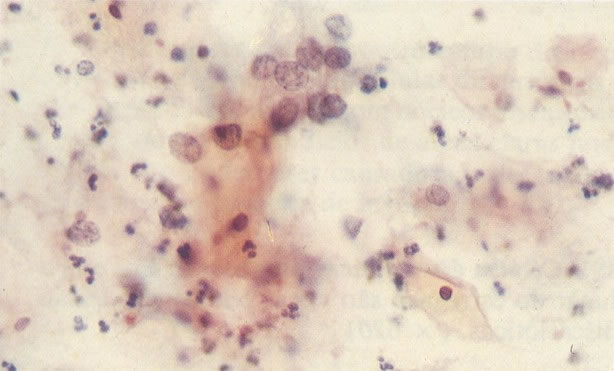
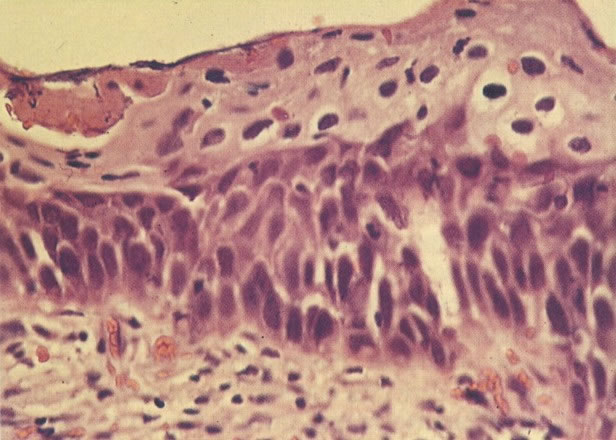
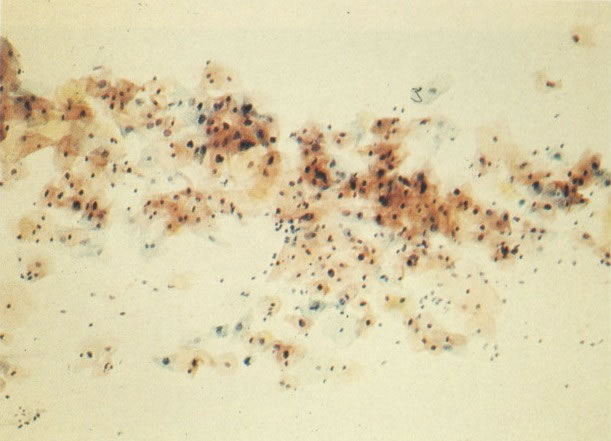
156. Células discarióticas e reativas. As células intermediárias neste campo estão levemente aumentadas, mas por outro lado, os núcleos são normais. Comparar estes com os núcleos densos vistos em duas células parabasais e uma célula intermediária pequena. Estas três células são eosinofílicas e levemente discarióticas (x 160)
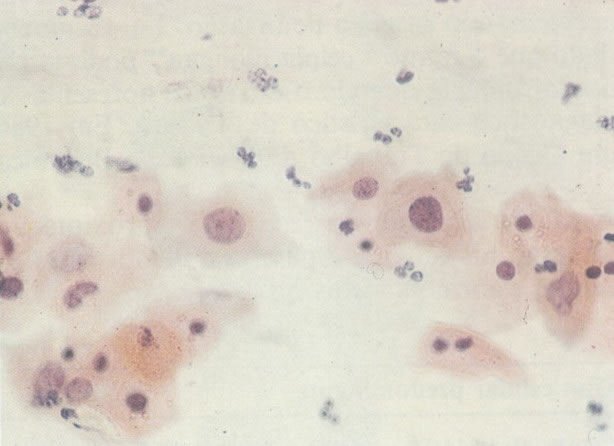
157. Discariose leve. Este é outro exemplo no qual, ambas as células de coloração anfofílica reativa e discariose leve. (x 160)
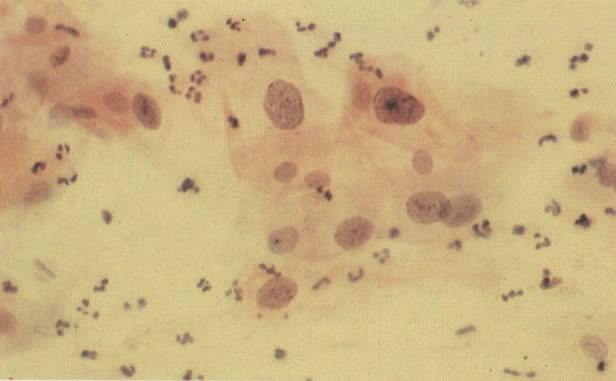
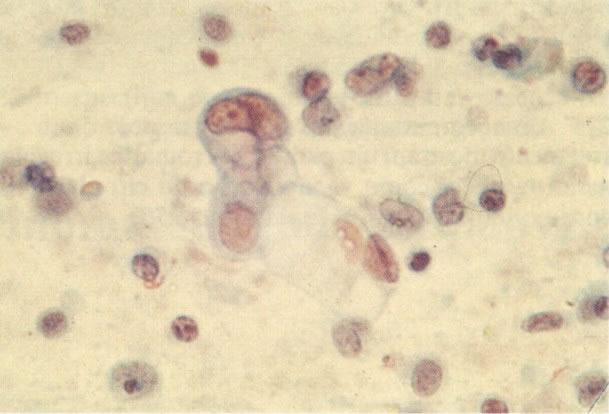
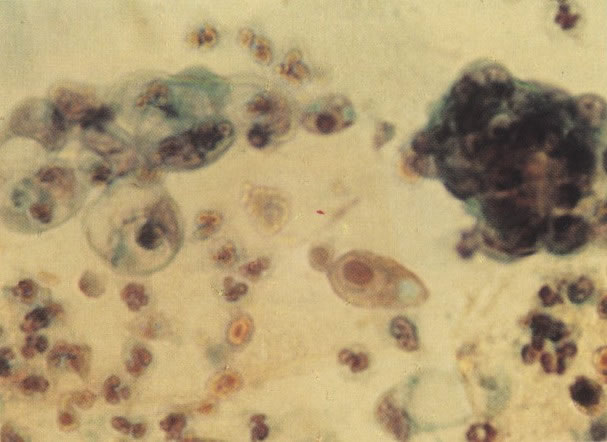
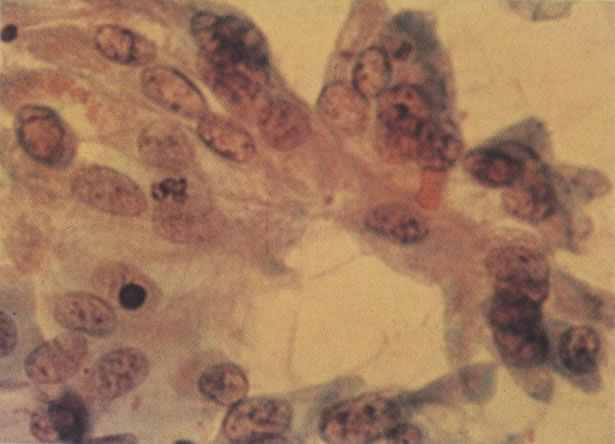
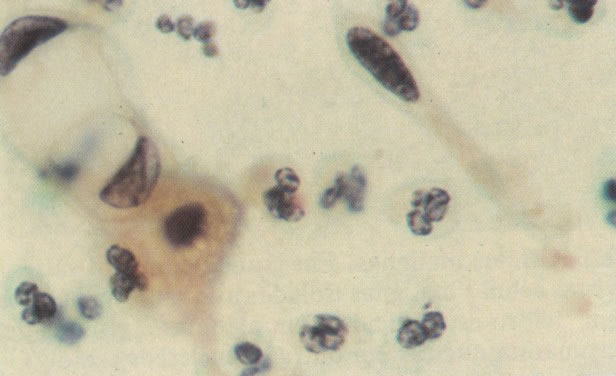
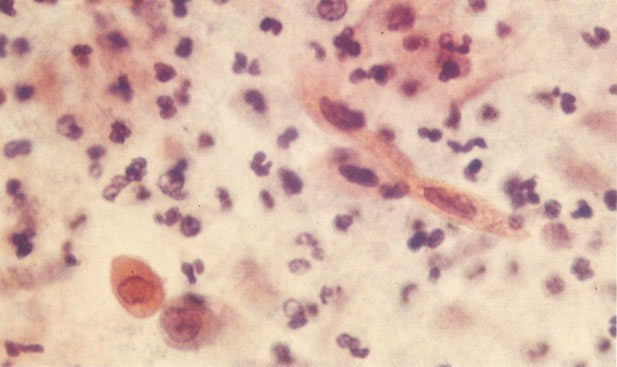
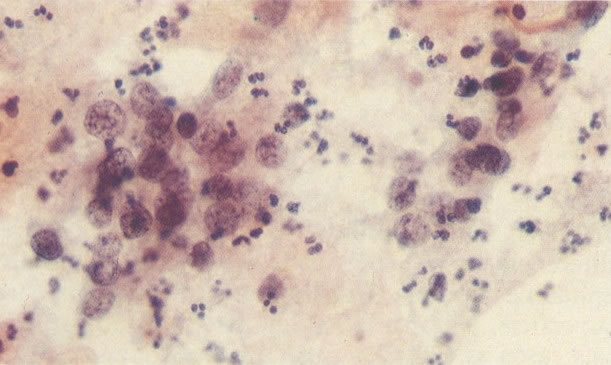
158. Discariose leve. Neste campo é visto um grupo de células levemente discarióticas bem diferenciadas. A coloração nuclear é clara, mas evidentemente granular. (x 120)
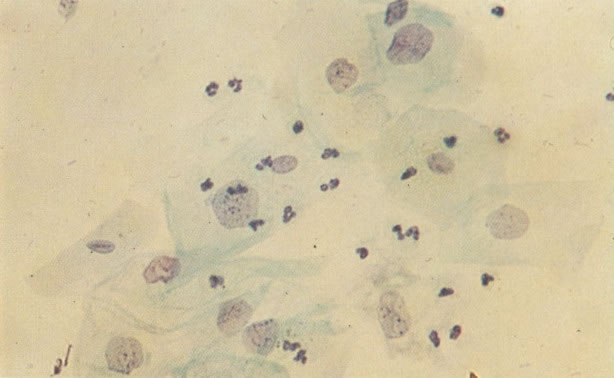
159. Discariose leve. Este é outro exemplo de células discarióticas de coloração clara. Notar a irregularidade da membrana nuclear em algumas das células. Algumas dessas alterações podem ser causadas por degeneração. (x 120)
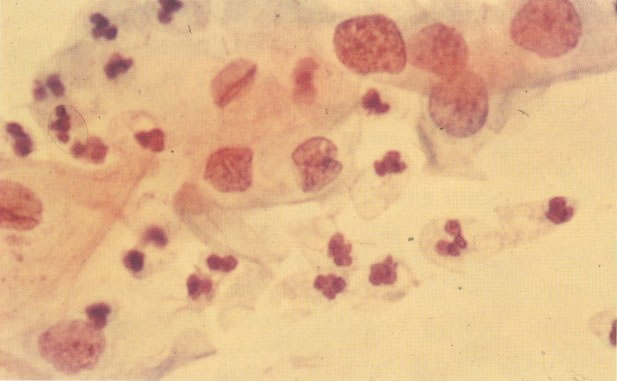
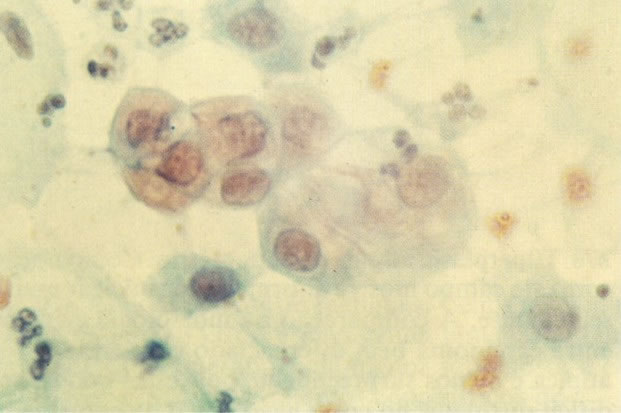
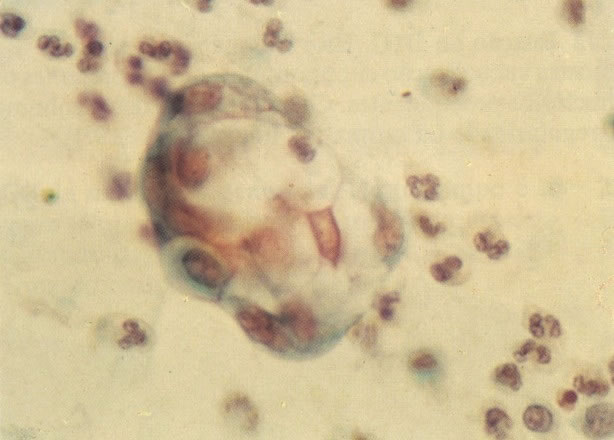
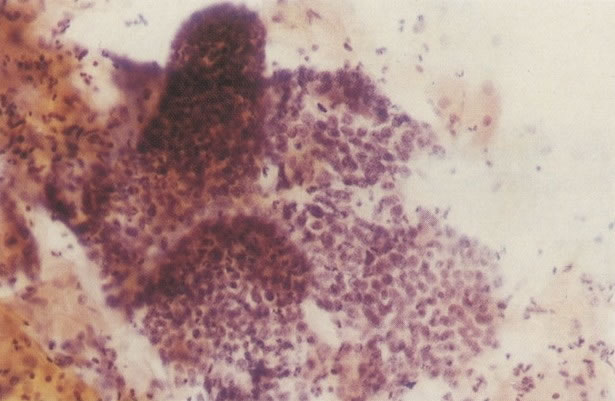
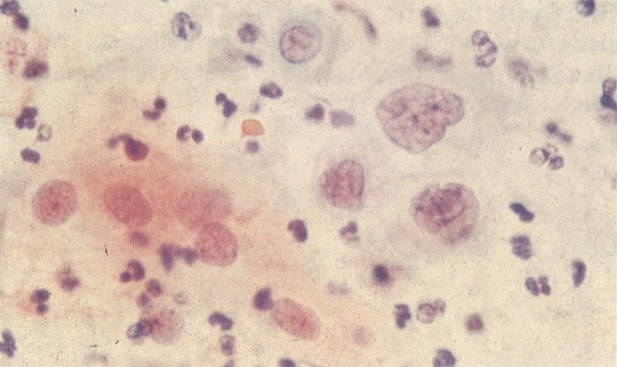
160. Discariose leve para moderada. Grupamento grosseiro de cromatina é mais aparente nestas células e em algumas, o núcleo ocupa mais que dois terços do citoplasma. (x 250)
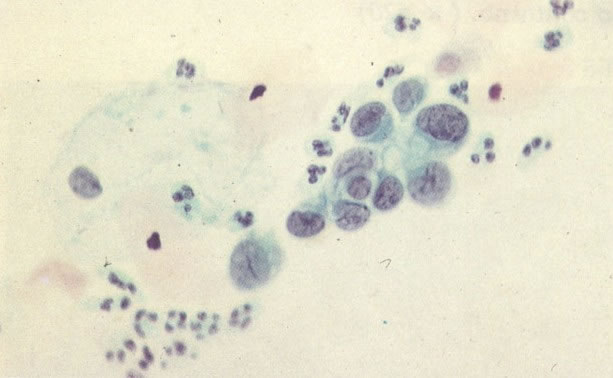
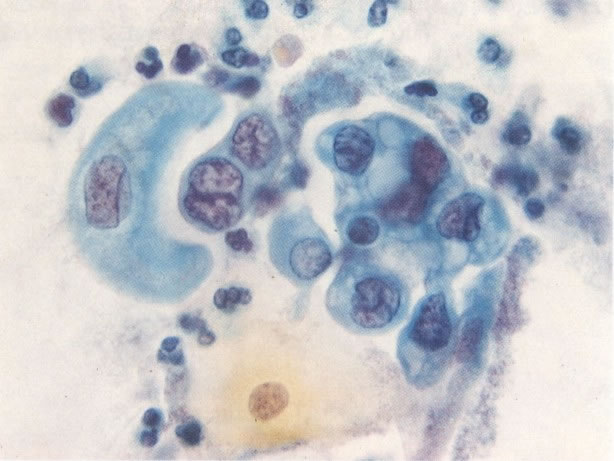
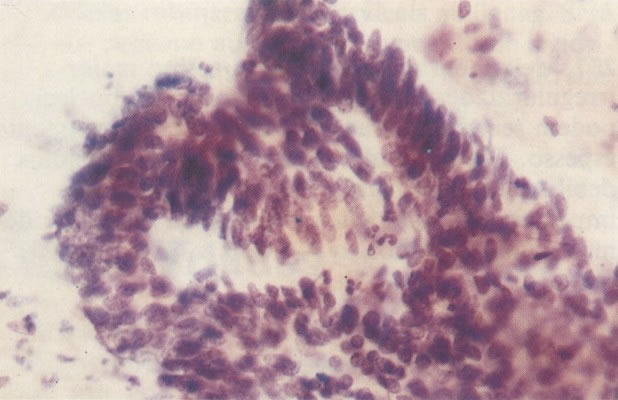
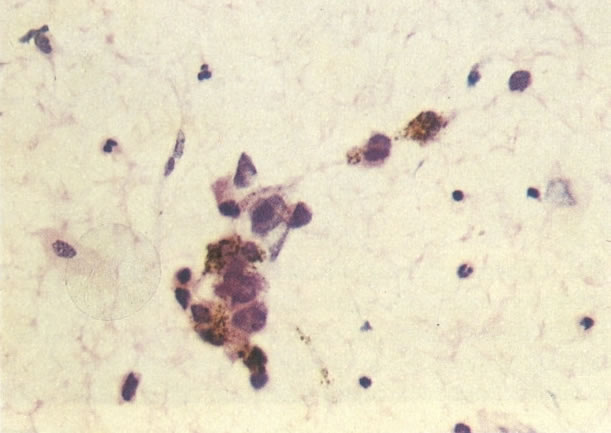
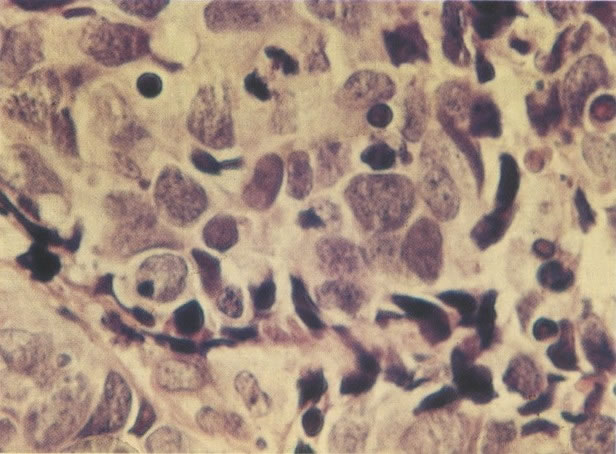
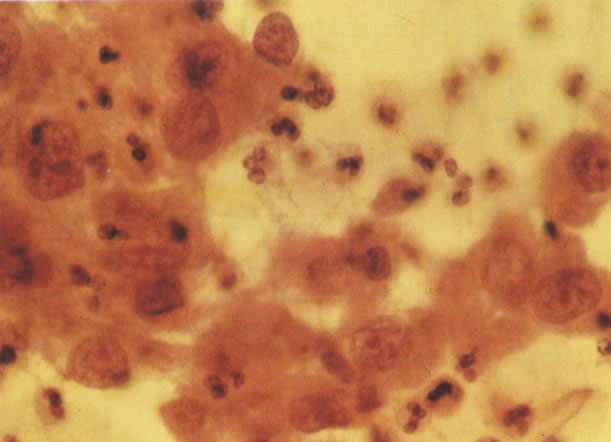
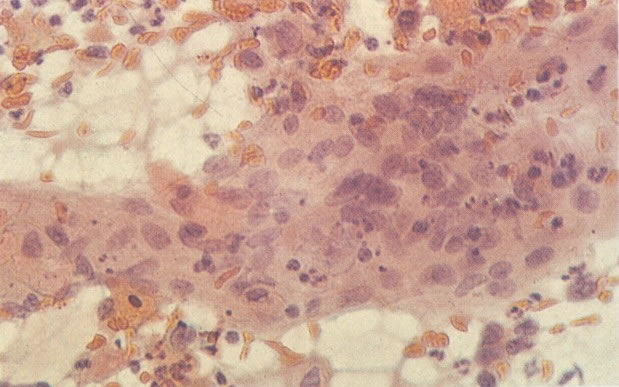
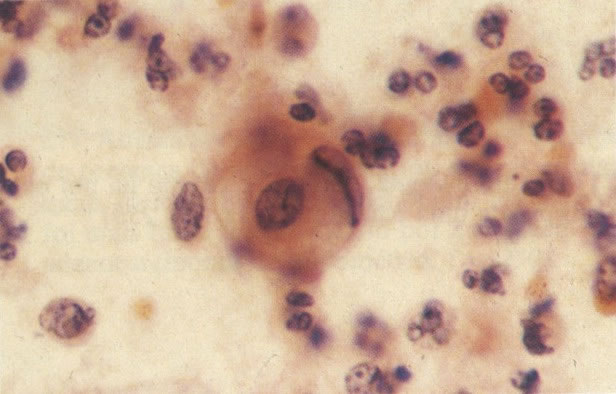
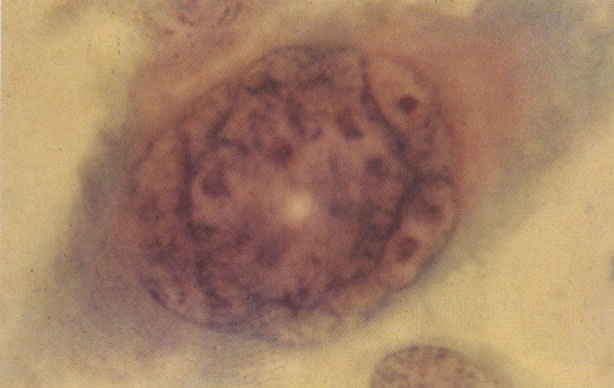
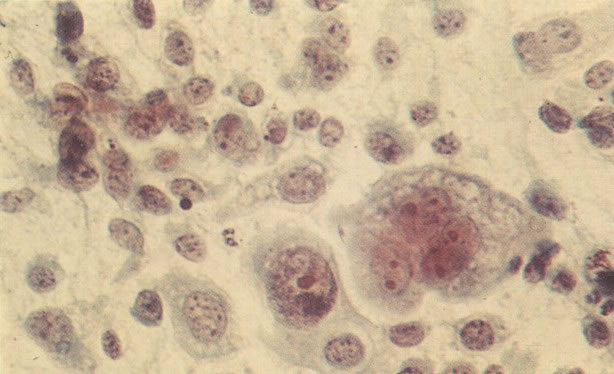
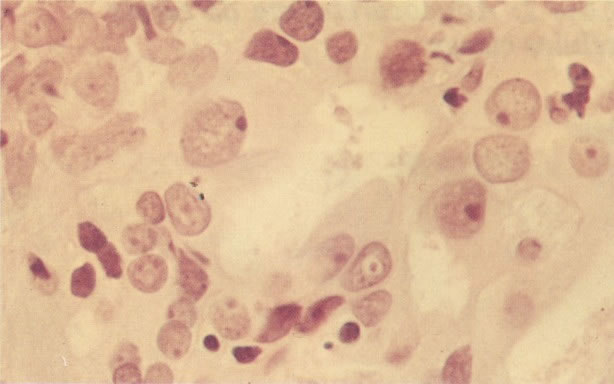
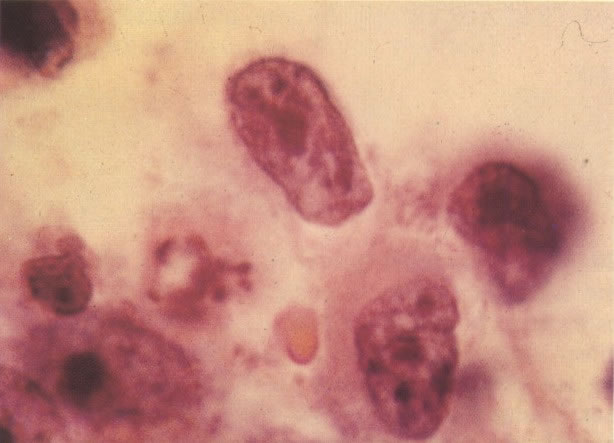
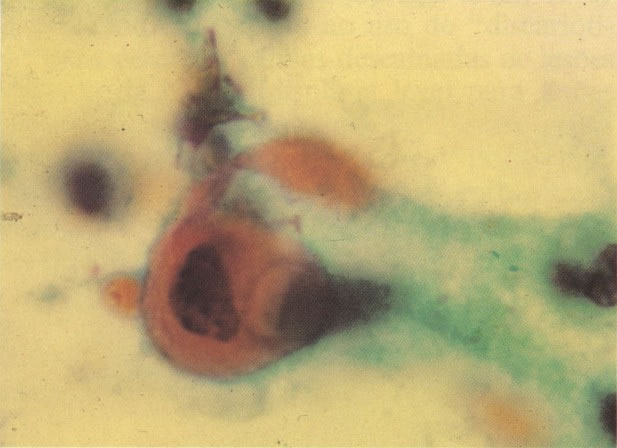
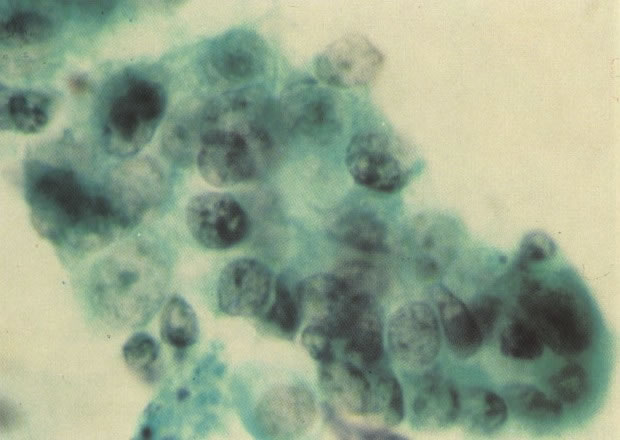
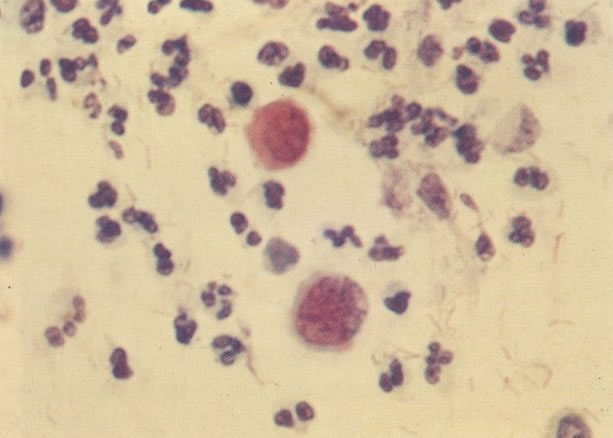
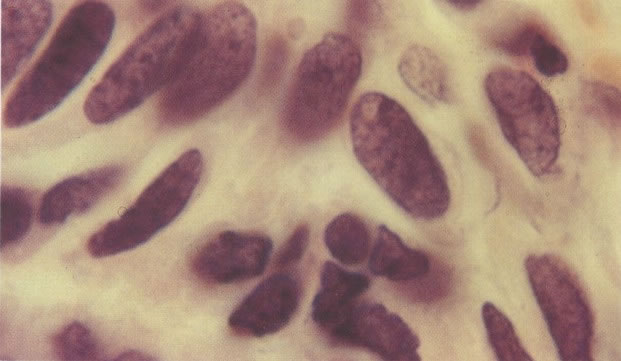
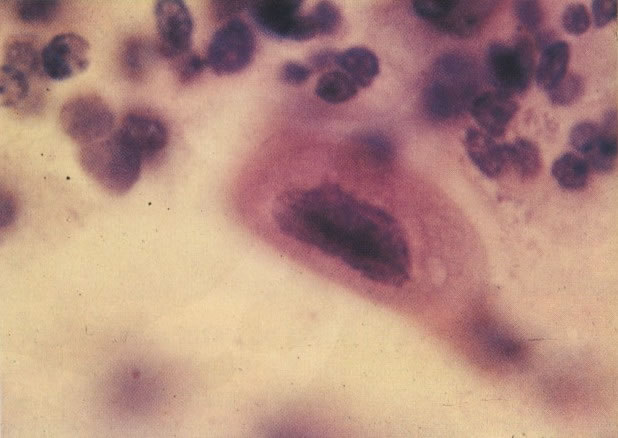
161. Discariose severa. Neste campo as células discarióticas mostram uma alta relação nucleocitoplasmática, com cromatina frouxa e mal definida em algumas células. (x 160)
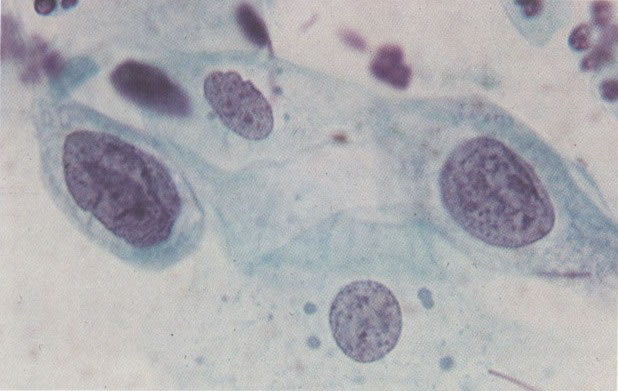
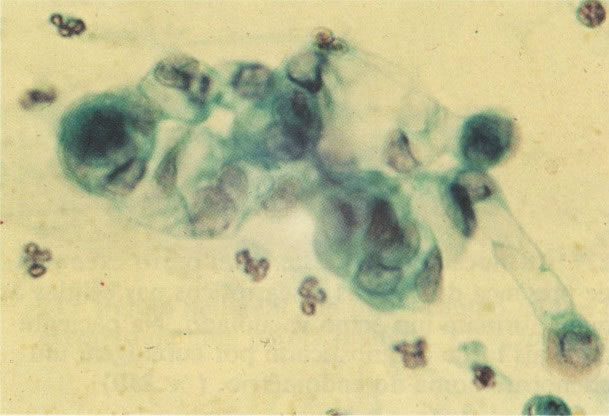
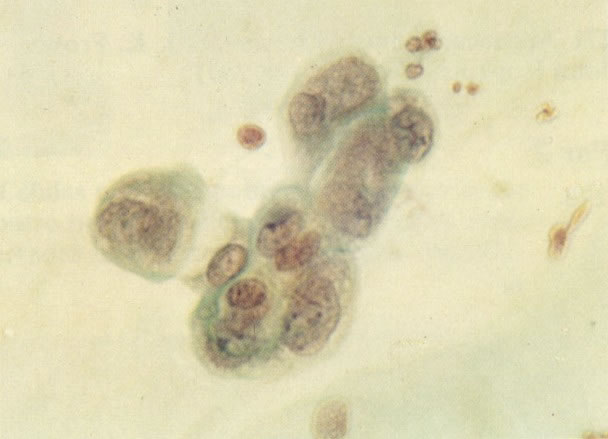
162. Discariose moderada para severa. Neste grupo em maior aumento, a aglutinação dos grânulos de cromatina é vista mais claramente. Há irregularidades levemente rígidas da membrana nuclear e a condensação irregular da cromatina é vista abaixo da membrana nuclear. Notar a nitidez da condensação, a qual caracteriza o aspecto da degeneração. (x 40)
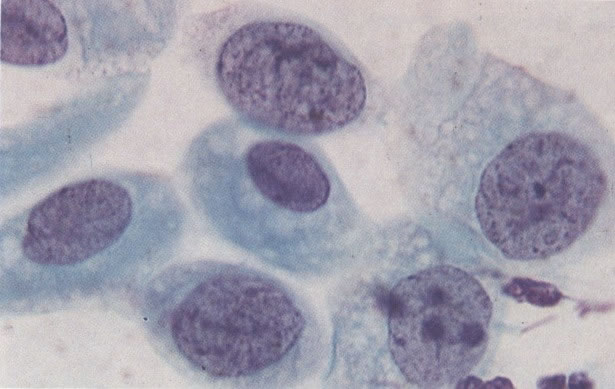
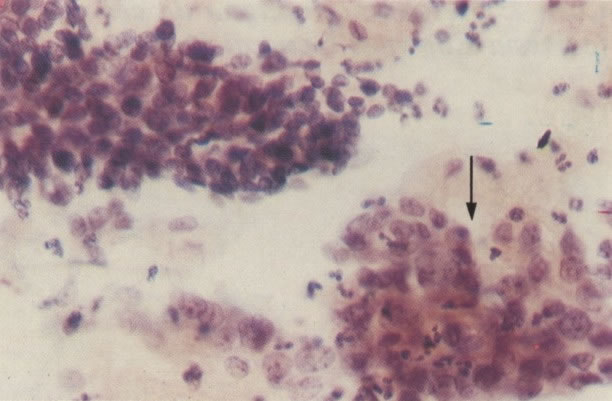
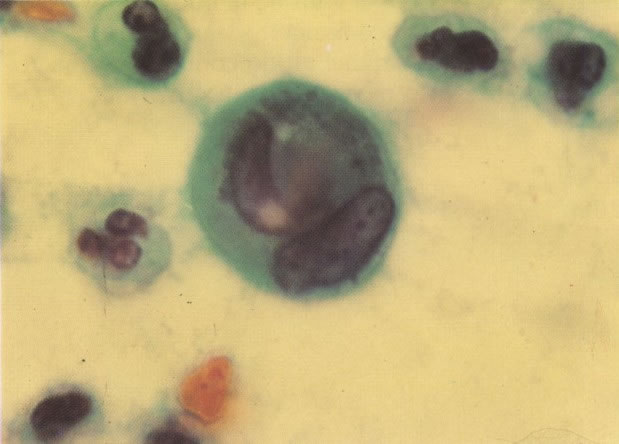
163. Discariose moderada para severa. Em outro campo do mesmo esfregaço, algumas células apresentam uma relação nucleocitoplasma muito alta. Um polimorfo fora de foco repousa sobre um núcleo e o núcleo central no topo do campo mostra grumos grosseiros de cromatina nuclear e um indício de clareamento, o qual indica possível invasão. (x 400)
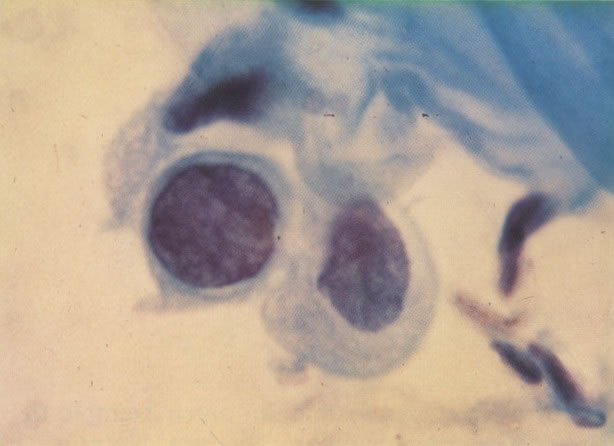
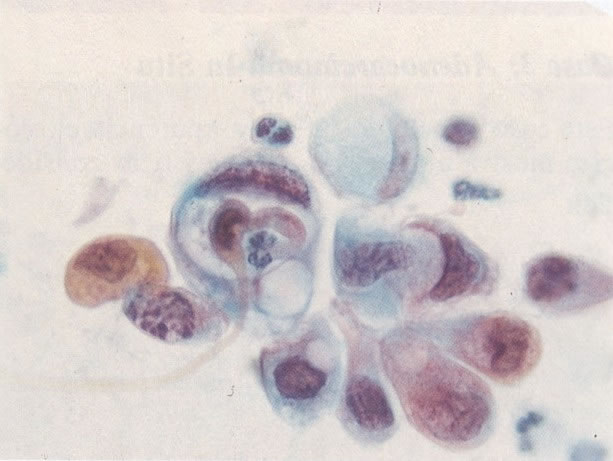
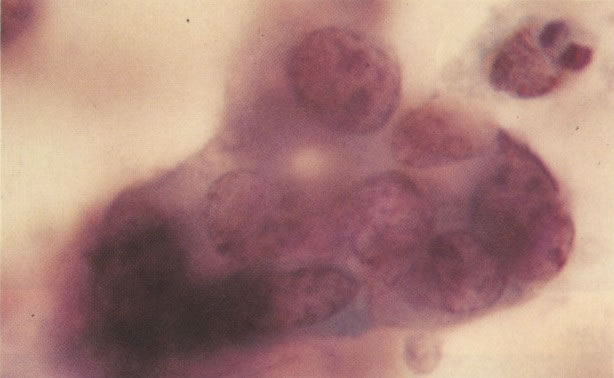
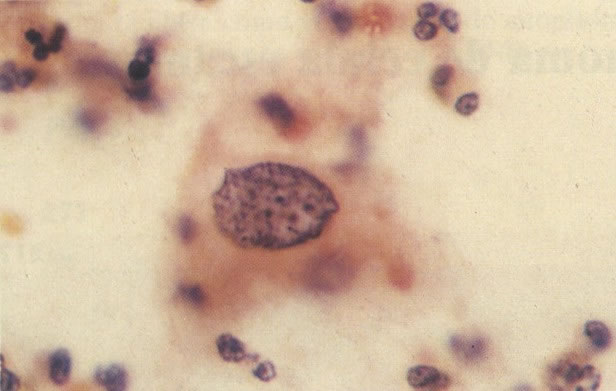
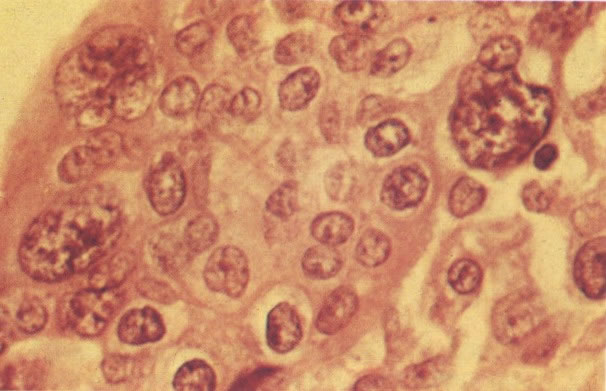
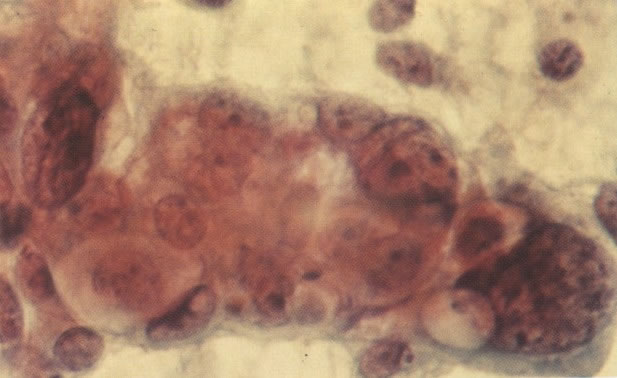
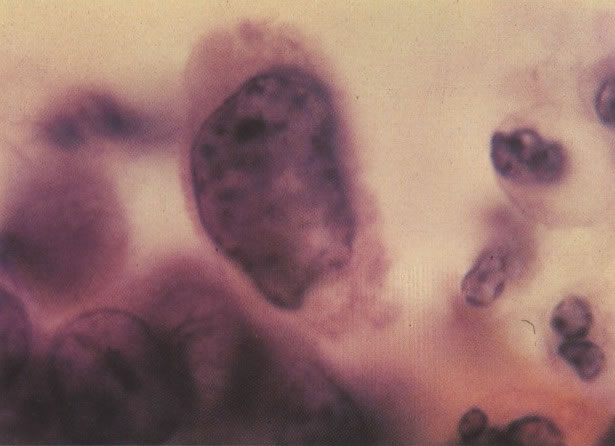
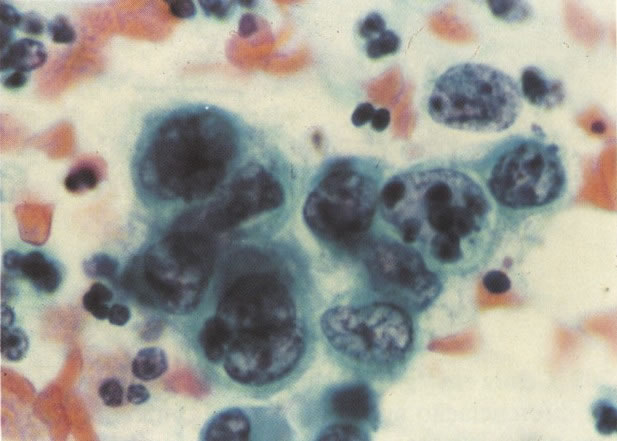
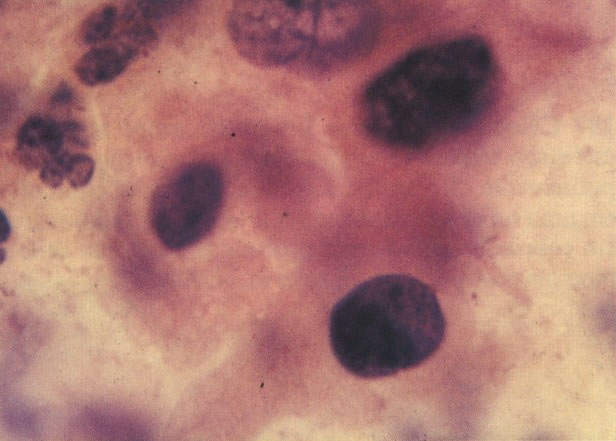
164. Discariose severa. Neste campo são vistas uma célula parabasal e uma discariótica indiferenciada. Notar a condensação de cromatina abaixo da membrana nuclear e irregularidades leves no contorno. (x 620)
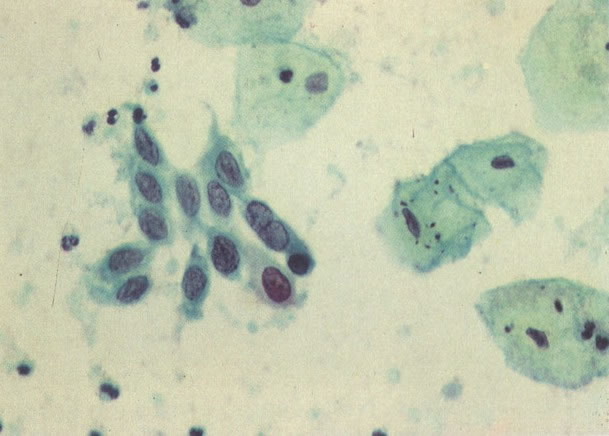
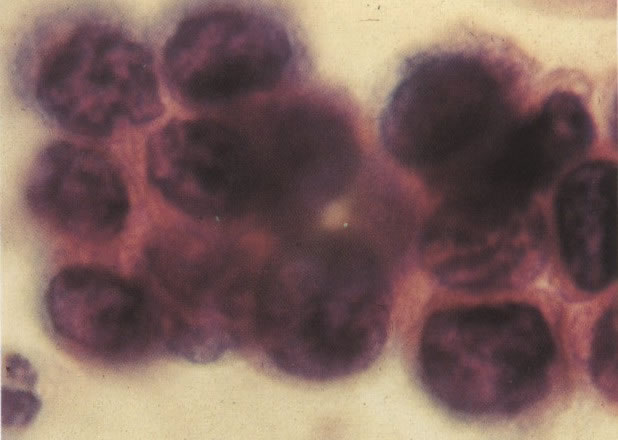
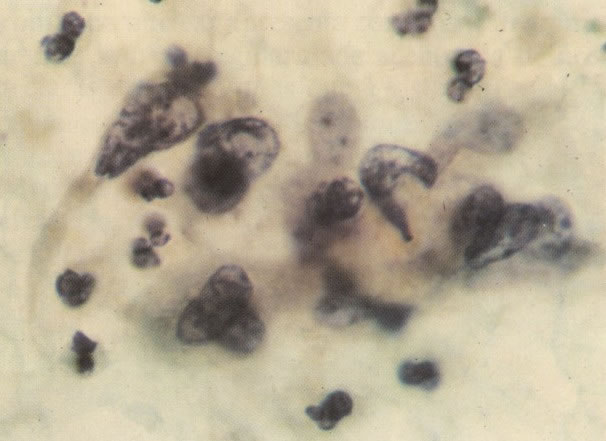
165. Discariose severa. Neste exemplo, em pequeno aumento, os núcleos são mais hipercromáticos, uma célula é binucleada e há condensação de cromatina na membrana nuclear em algumas células. (x 160).
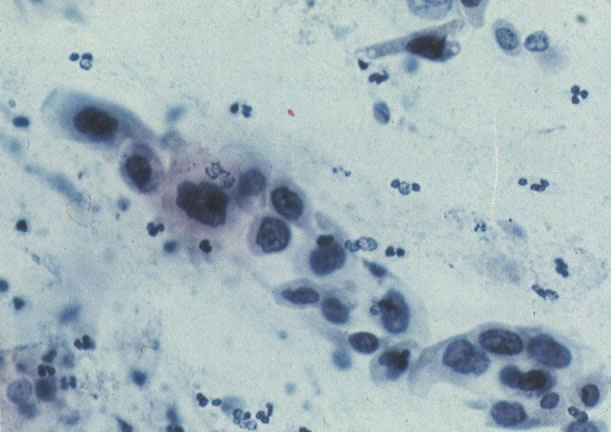
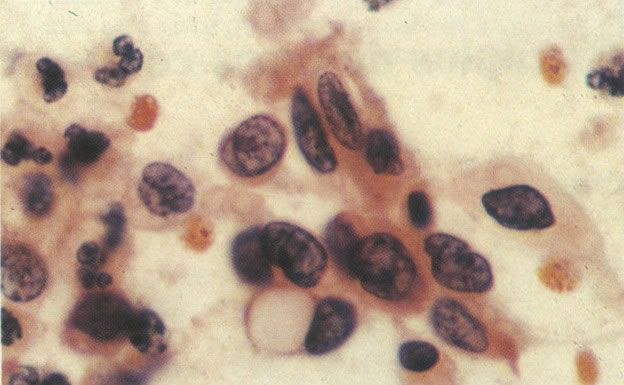
166. Discariose severa. Este campo é semelhante, mas há borramento dos detalhes nucleares como resultado de degeneração. (x 160)
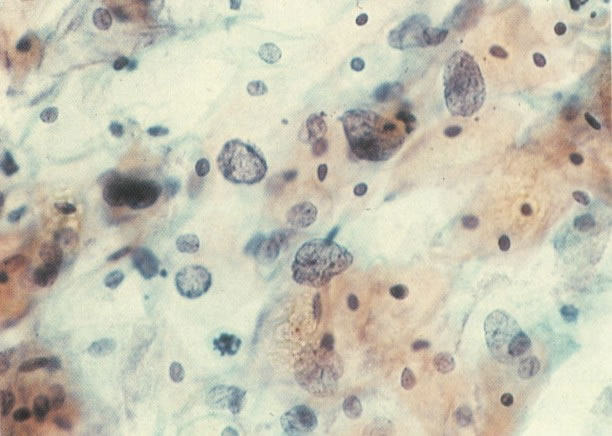
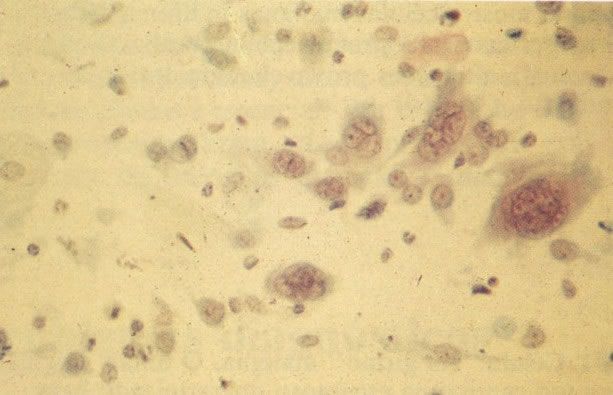
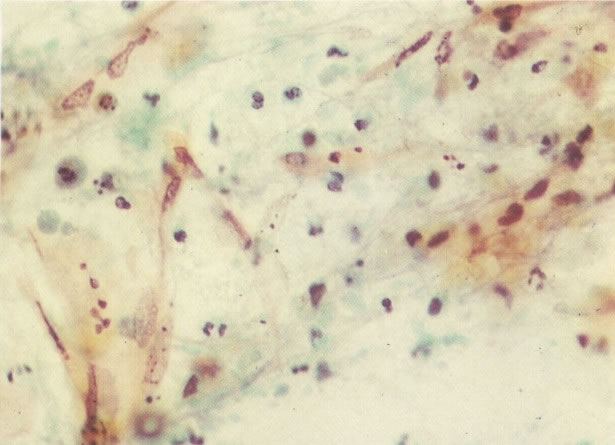
167. Discariose severa. Este campo contém núcleos discarióticos desnudos, superpostos a um fundo de células escamosas normais. A falta de citoplasma tona difícil avaliar a anormalidade histológica esperada, mas o tamanho do núcleo faz NIC I ser improvável. (x 160)
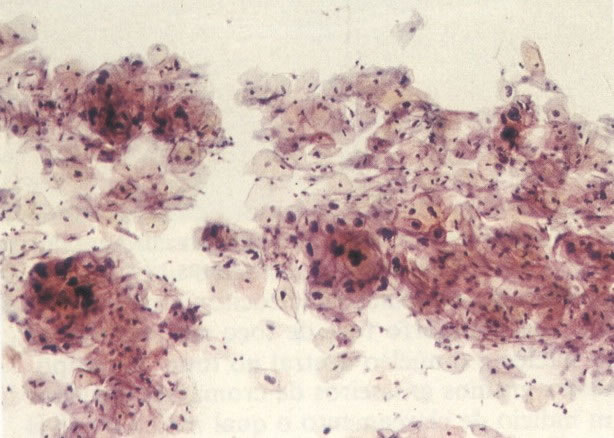
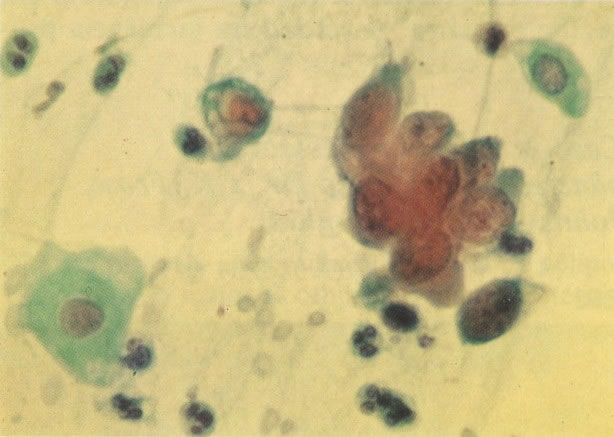
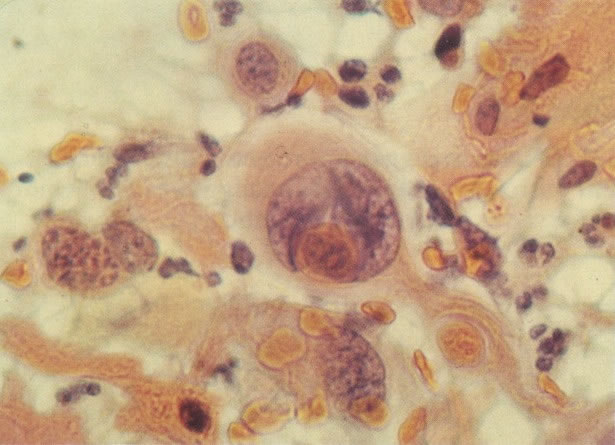
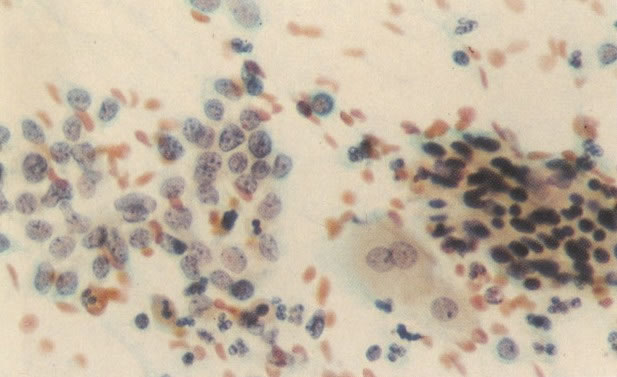
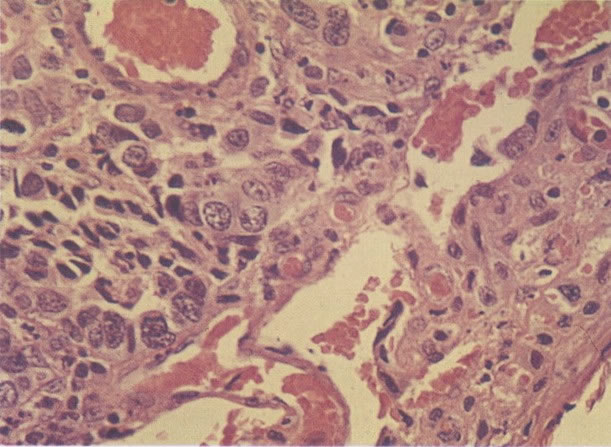
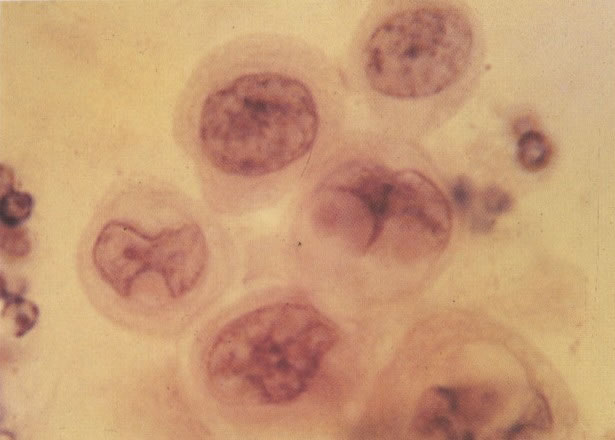
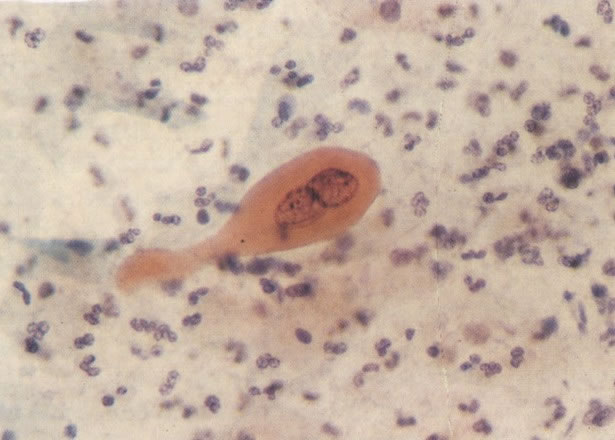
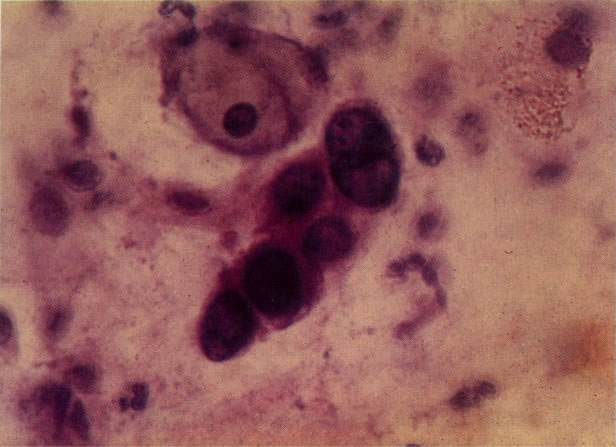
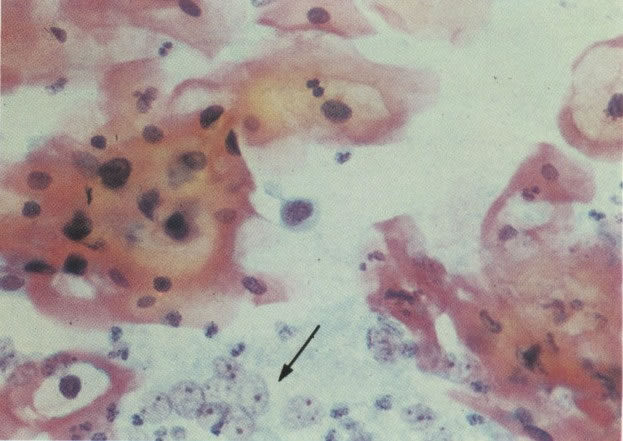
168. Discariose severa e infecção por HPV. Comparar 131 e 132. Mesmo em pequeno aumento, pode-se ver que a anormalidade nuclear é mais severa neste campo, no qual também aparecem coilócitos. (x 40)
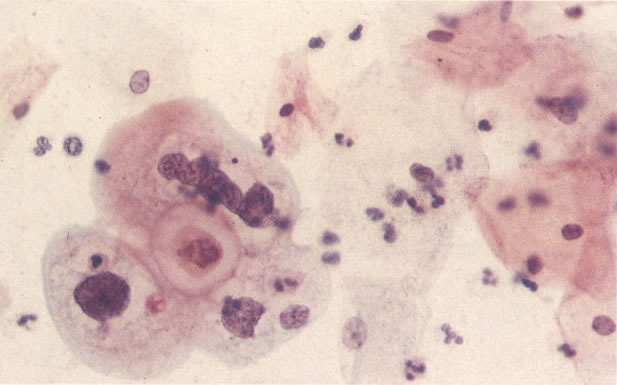
169. Discariose leve e infecção por HPV. Em maior aumento, a condensação dos grânulos é vista em células multinucleadas e no coilócito jovem. (x 160)
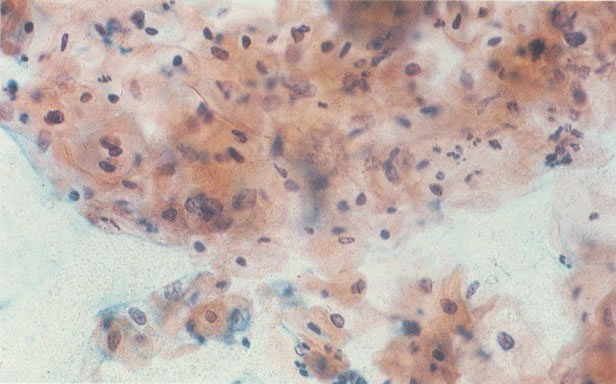
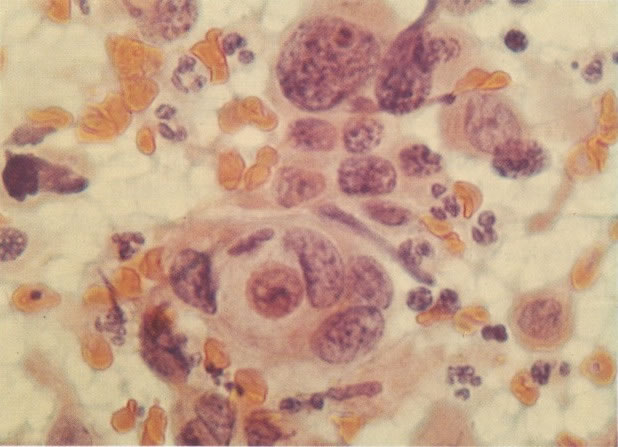
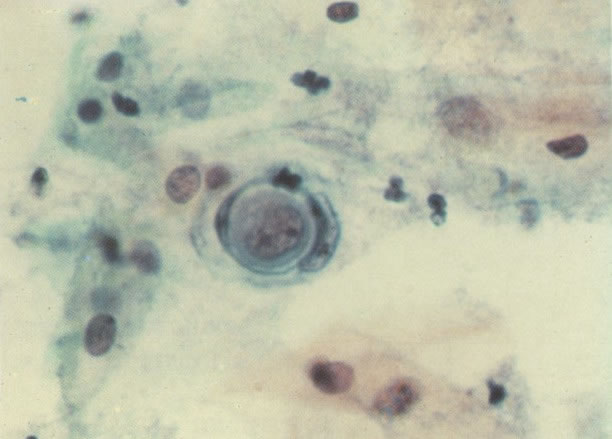
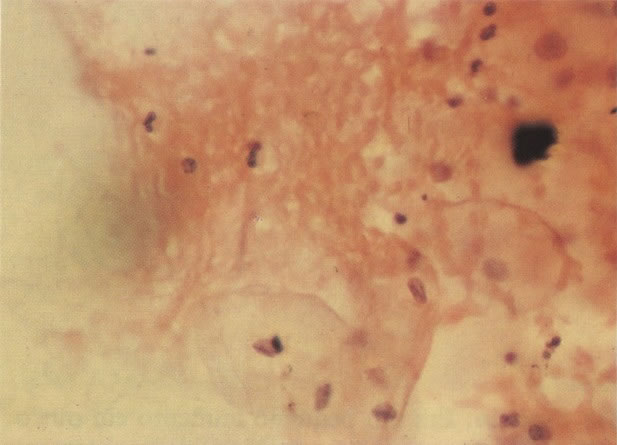
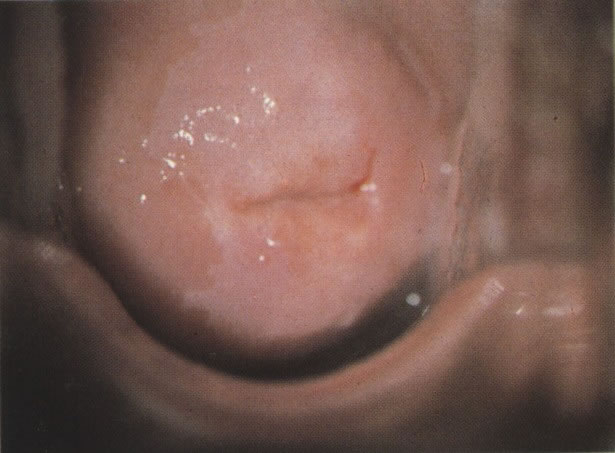
170. Discariose leve com provável infecção por HPV. Célula discariótica e células apresentando alterações degenerativas são vistas entre células queratinizada. Nenhum coilócito está presente, mas é provável que este seja um caso de infecção por HPV. Embora a aparência sugira somente NIC I, células refletindo superfície queratótica, tornam aconselháveis a colposcopia e biópsia. (x 100)
[Voltar]