Sob a influência dos estrógenos, a cérvix torna-se evertida para expor o epitélio colunar do canal cervical. Isto é mais acentuado na puberdade e durante a gestação. É também visto em mulheres com estrógenos elevados por contraceptivos orais. O pH ácido da vagina estimula a substituição do epitélio colunar com epitélio escamoso por um processo de metaplasia escamosa (Singer & Jordan, 1976). A área na qual isto ocorre inicialmente é conhecida como “Zona de Transformação”. Nos estágios iniciais da metaplasia escamosa, células indiferenciadas multiplicam-se entre células colunares e a membrana basal. Isto pode se originar no local, mas quando houver destruição da superfície epitelial, por exemplo, por laser ou diatermia, forma-se uma camada celular semelhante. Isto sugere migração do estroma, o qual pode também ser o caso na metaplasia fisiológica. Em um estágio mais tardio, as células se estratificam e o epitélio é reconhecidamente escamoso, eventualmente a maturação é indistinguível do epitélio escamoso original. Embora a camada epitelial pareça mesma, o epitélio pode ser reconhecido como metaplásico por causa das criptas endocervicais serem vistas no estroma subjacente.
Grupos de células metaplásicas imaturas podem ser identificadas no esfregaço cervical. Elas são vistas como células parabasais em um campo, o qual de outra maneira, consiste de células escamosas maduras. Nesses casos elas são rarefeitas como células metaplásicas. Elas podem estar associadas com células colunares e sua presença em um esfregaço também indica um espécime aceitável para avaliação. As figuras nesta seção ilustram o processo de metaplasia escamosa e também mostram a variação de aparência de células metaplásicas.
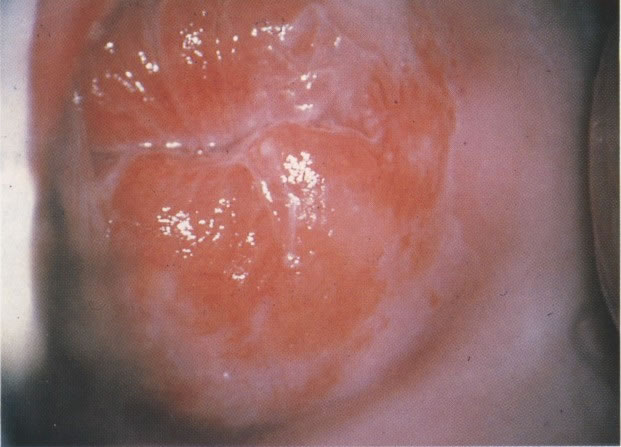
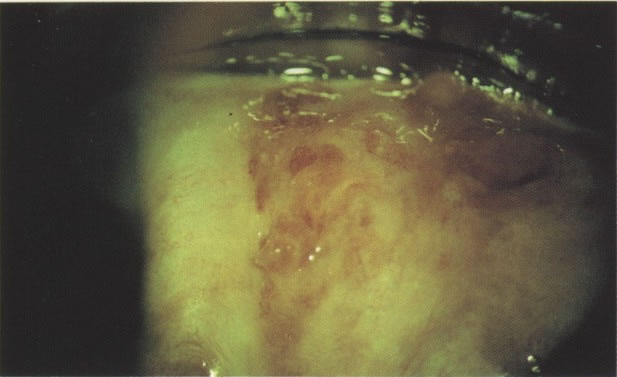
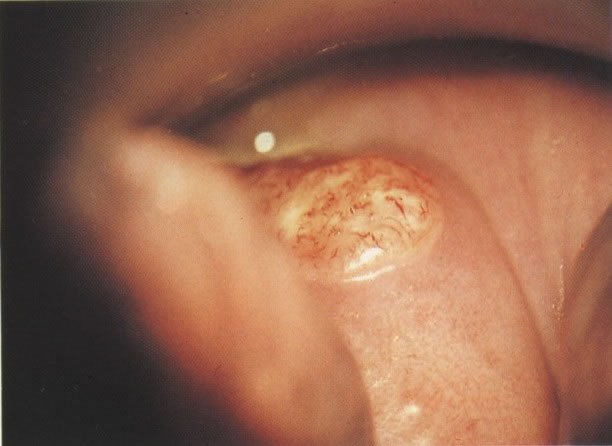
18. Ectopia com zona de transformação recente: colposcopia. Aqui a cérvix evertida mostra as dobras do epitélio colunar endocervical vascular. Na extremidade periférica do colo uterino, o epitélio escamoso liso original está presente. Entre essas áreas e em quase toda ectopia há metaplasia imatura a qual torna-se branca após aplicação de ácido acético a 4% (ácido acético, X 160)
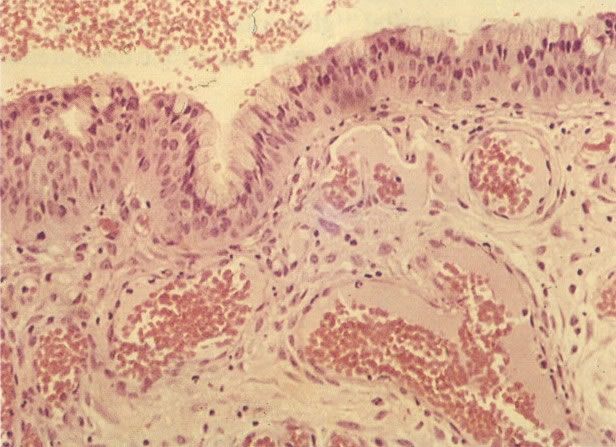
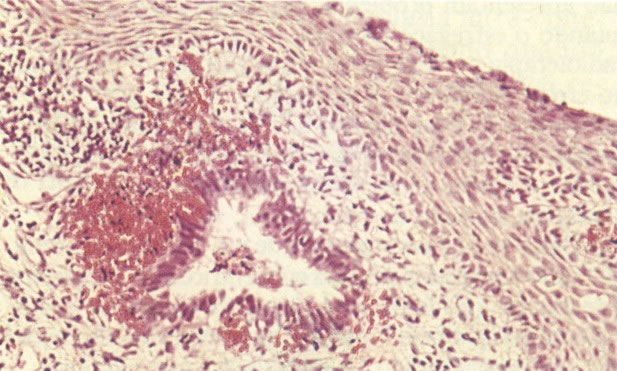
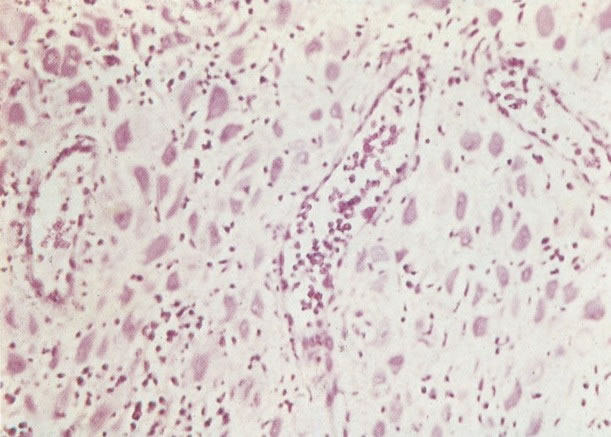
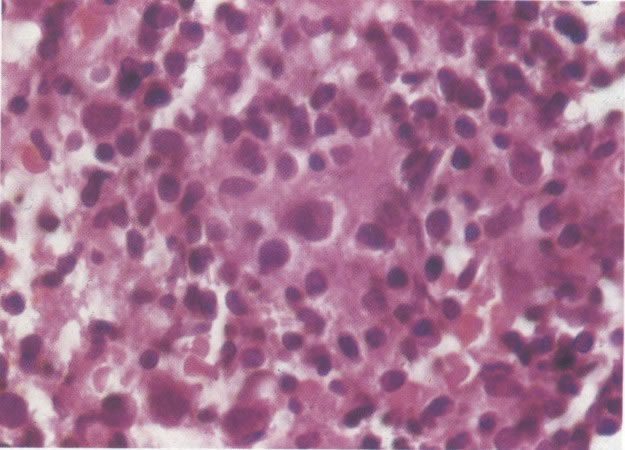
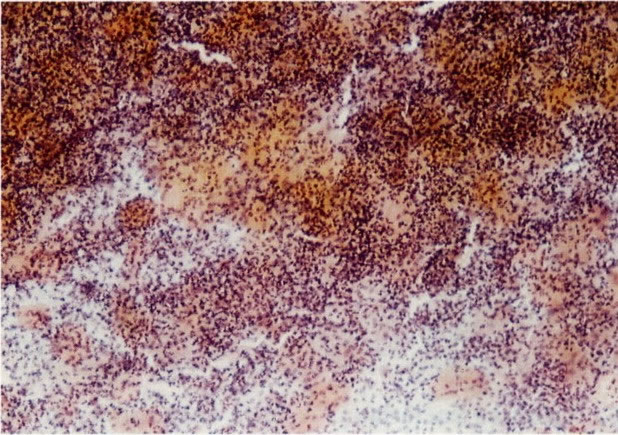
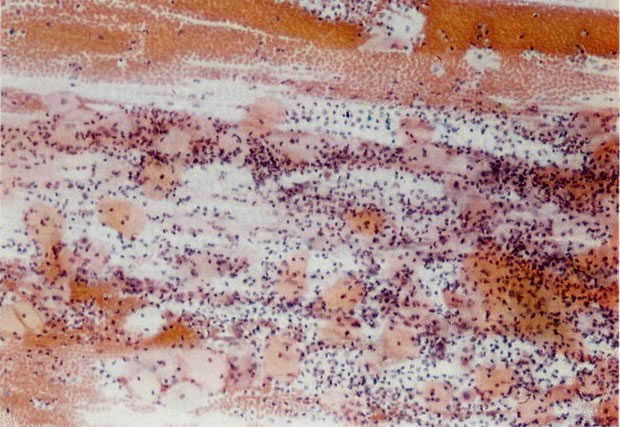
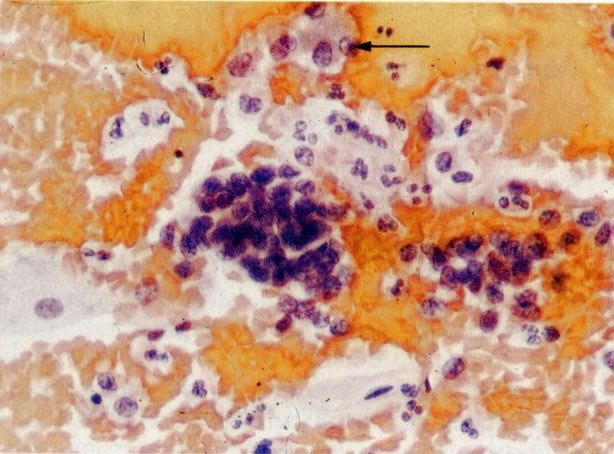
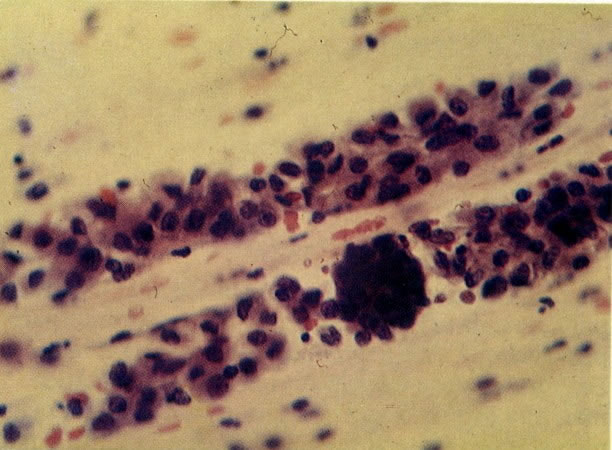
19. Cérvix: hiperplasia de células de reserva. Esta secção mostra a replicação de células indiferenciadas profundas do epitélio colunar o qual é chamado de hiperplasia de células de reserva. (H & E, X 62)
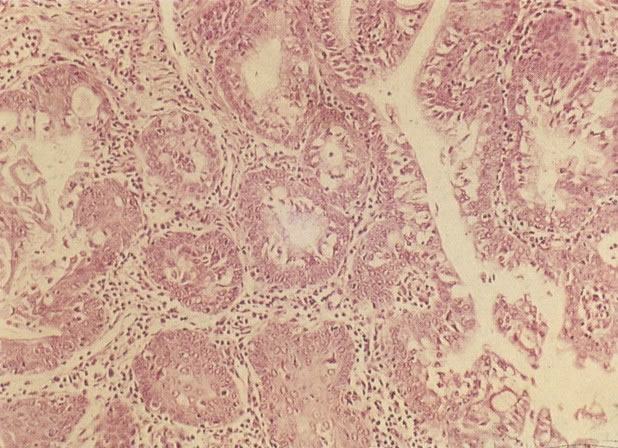
20. Cérvix: hiperplasia de células de reserva: envolvimento glandular. Neste campo as ramificações das criptas no estroma são vistas estar submetendo-se ao mesmo processo de hiperplasia de células de reserva. (H & E, X 37,5)
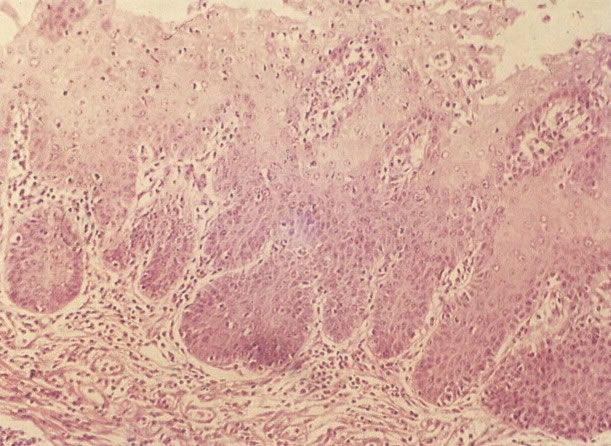
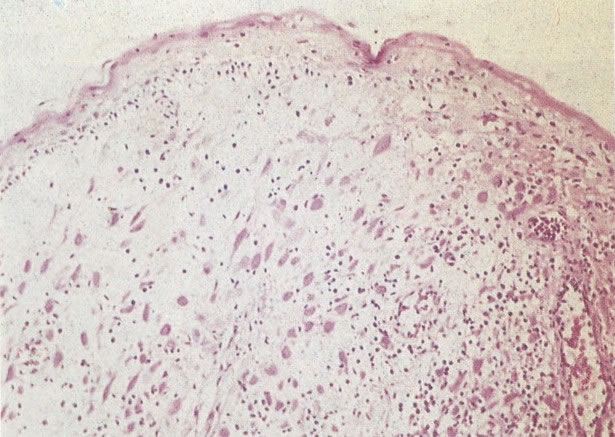
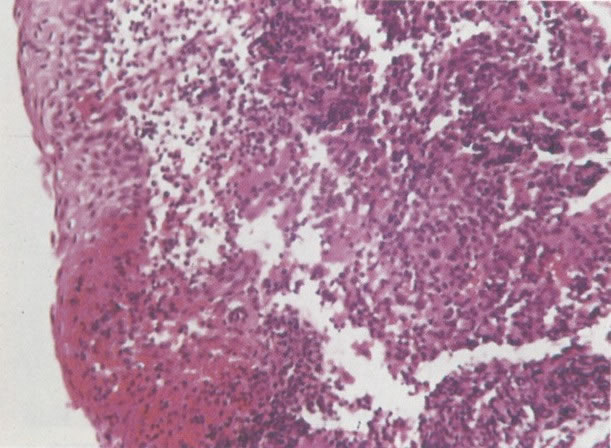
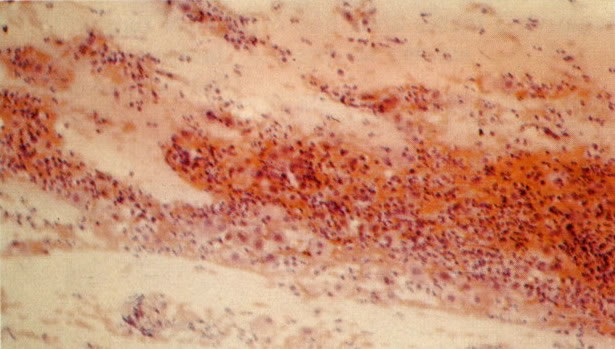
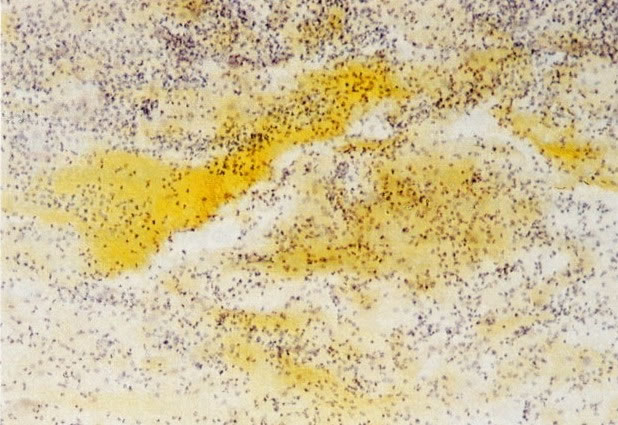
21. Cérvix: metaplasia imatura escamosa. Nos estágios tardios as camadas de células imaturas, em ambas as superfícies e criptas, estão começando a estratificar e pode ser reconhecido um epitélio escamoso imaturo. (H & E, X 37,5)
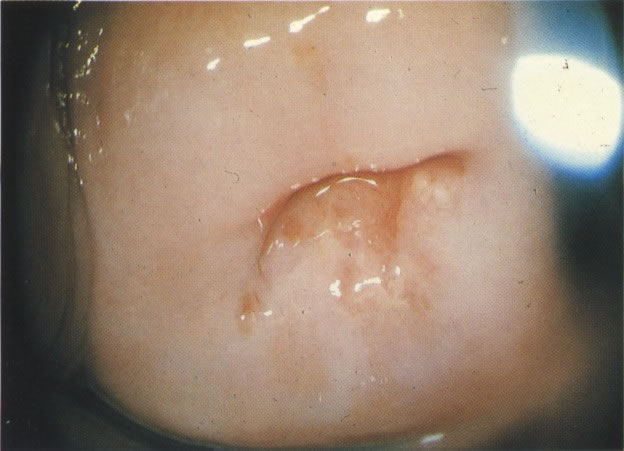
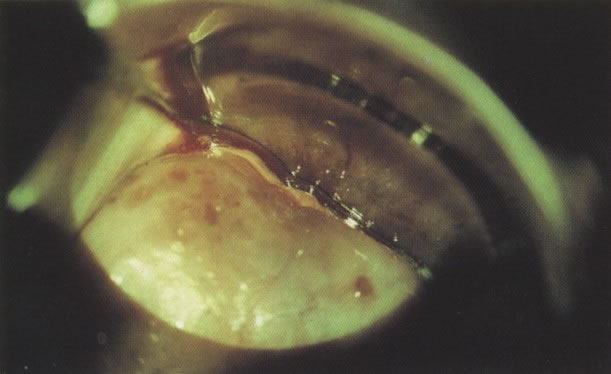
22. Zona de transformação típica: colposcopia. Aqui o epitélio colunar da ectopia é substituído pelo epitélio metaplásico maduro. Quando visualizado tridimensionalmente através do colposcópio, é normalmente possível ver o entalhe arredondado no colo que identifica o nível da junção escamocolunar original. A nova junção escamocolunar é vista no orifício externo. Entre a original e a nova junção escamocolunar existe o epitélio escamometaplásico maduro. (ácido acético, X 16)
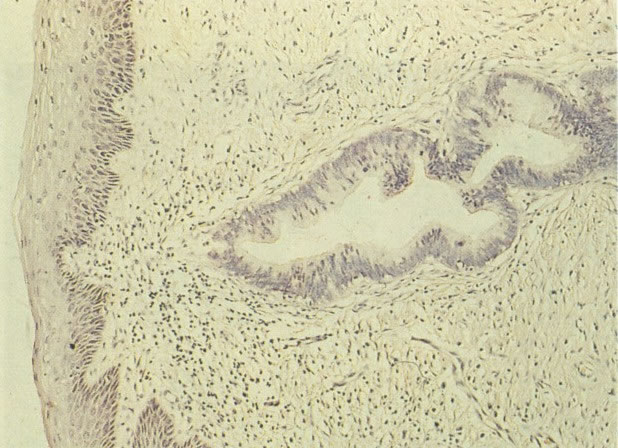
23. Epitélio metaplásico maduro com cripta subjacente. Este campo mostra epitélio escamoso metaplásico maduro. Histologicamente parece-se com o epitélio escamoso original e é distinguido pela cripta no estroma subjacente. (H & E, X 40)
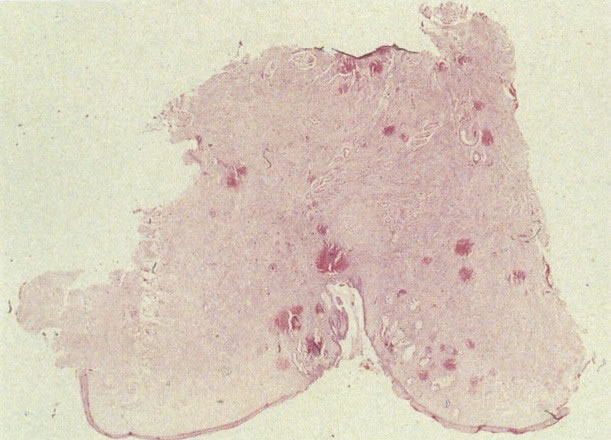
24. Corte da cérvix. Este é um corte espesso da cérvix. Demonstra epitélio escamoso original e epitélio colunar, com epitélio metaplásico entre eles. Notar criptas profundas no epitélio metaplásico maduro e também a profunda penetração das criptas no estroma. (H & E, X 1)
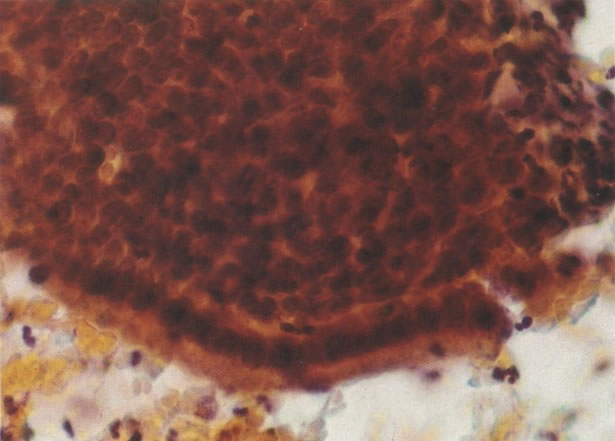
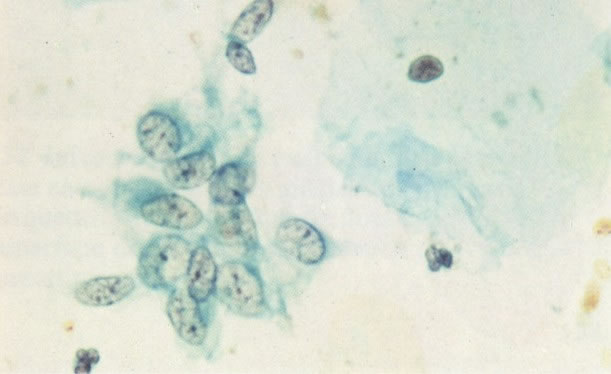
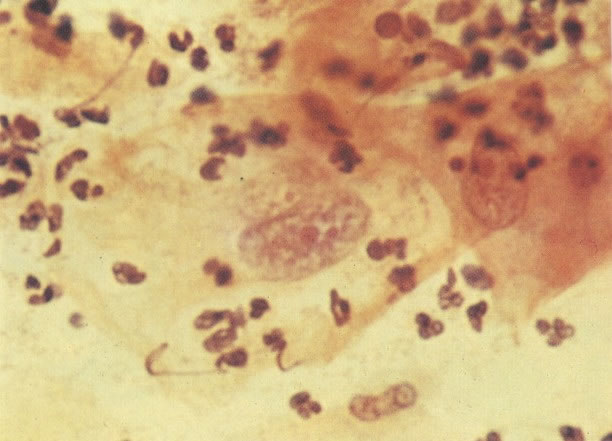
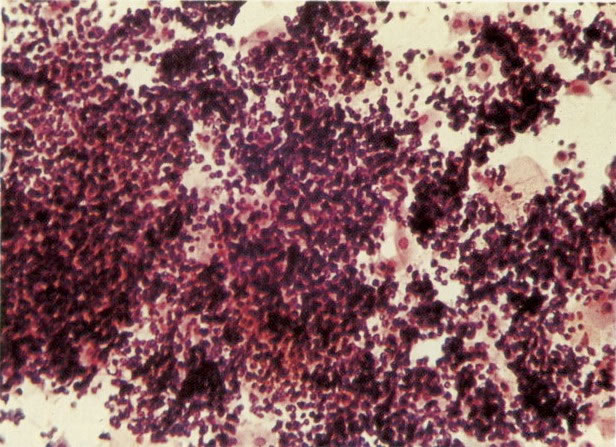
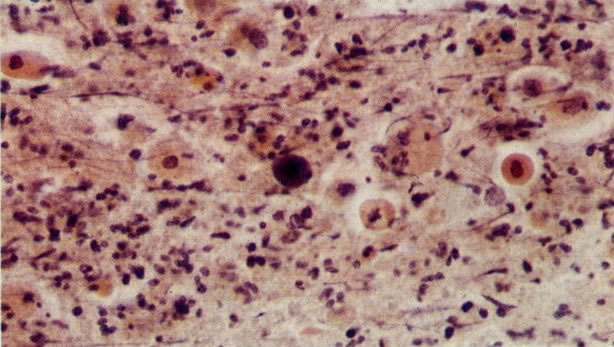
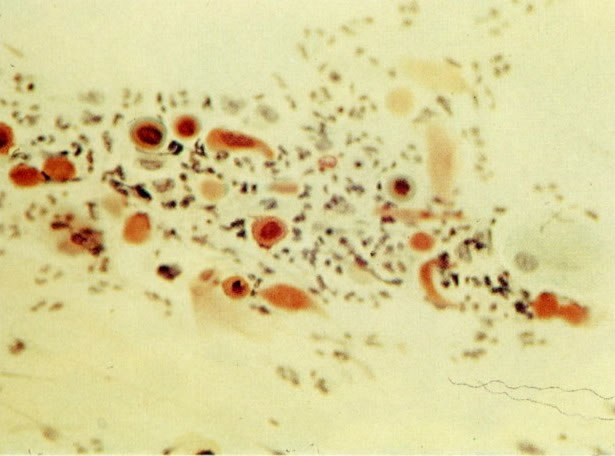
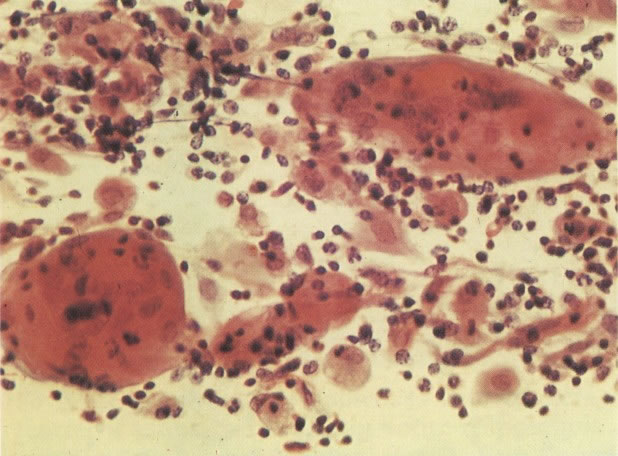
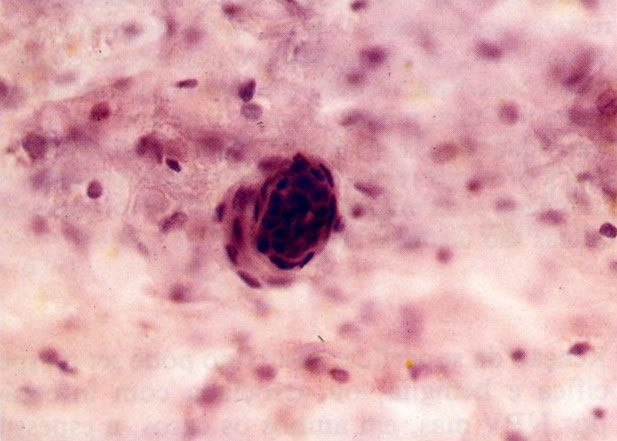
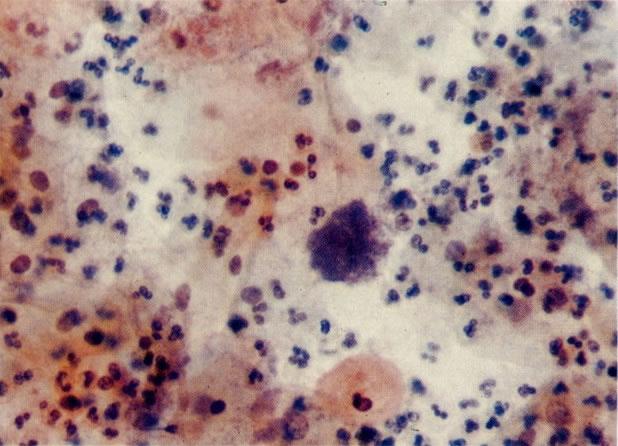
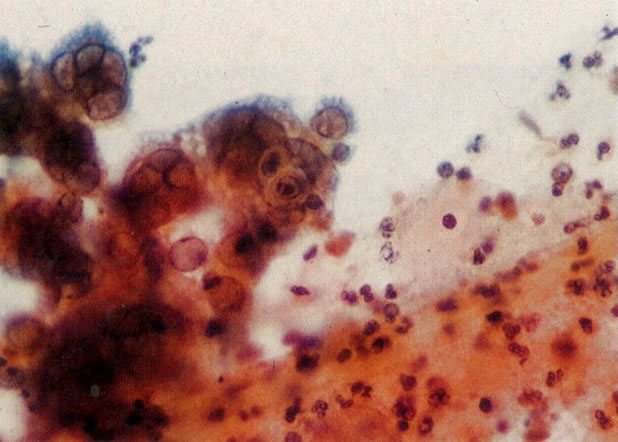
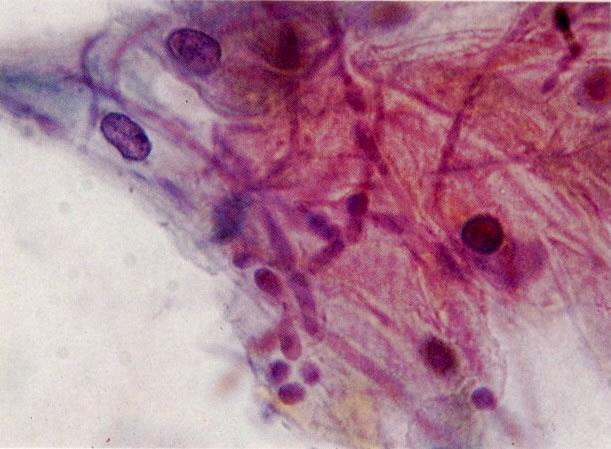
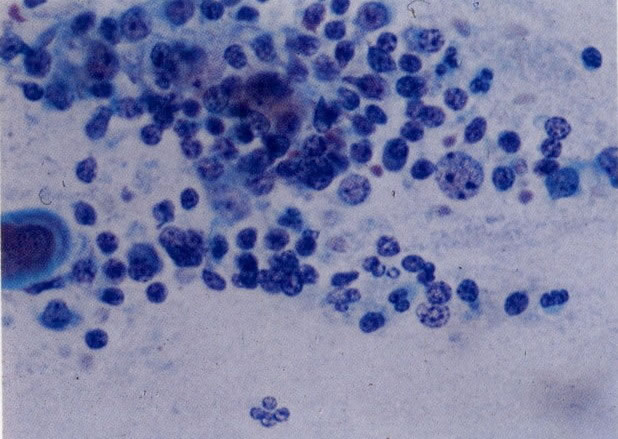
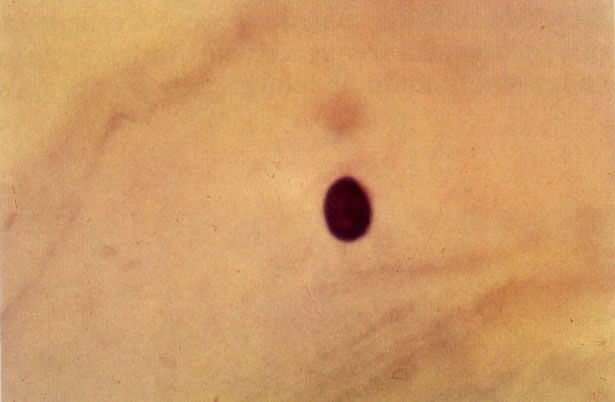
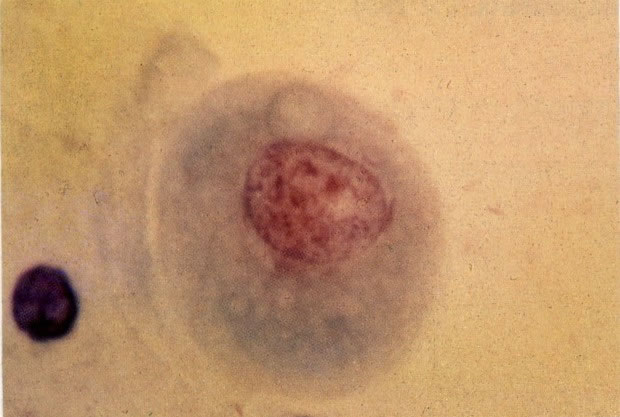
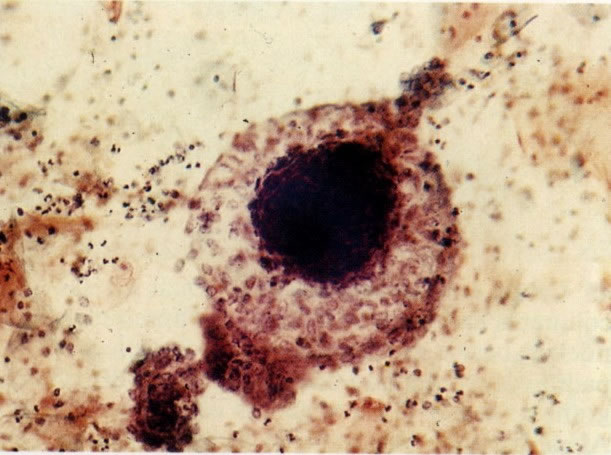
25. Células colunares endocervicais de reserva. Este campo mostra um fragmento de tecido o qual consiste de uma fileira de células colunares endocervicais e células de reserva subjacentes. (X 160)
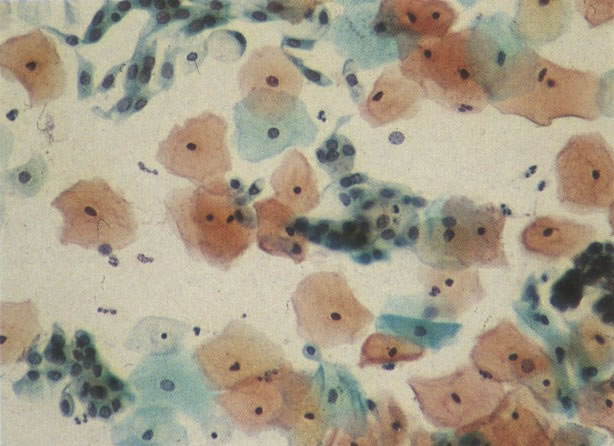
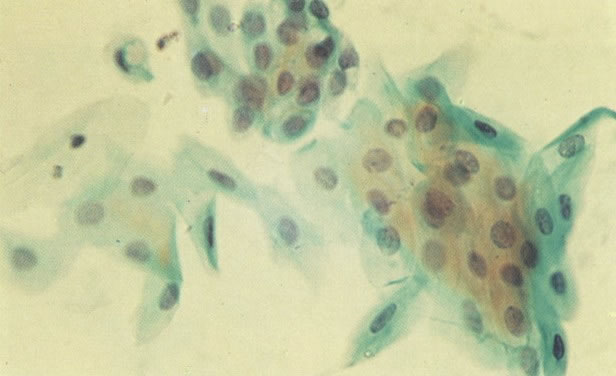
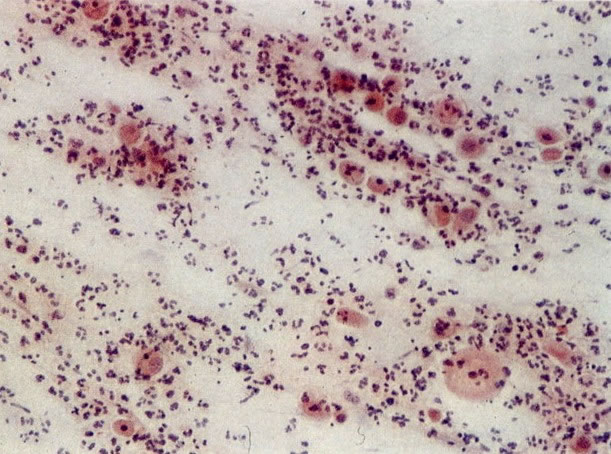
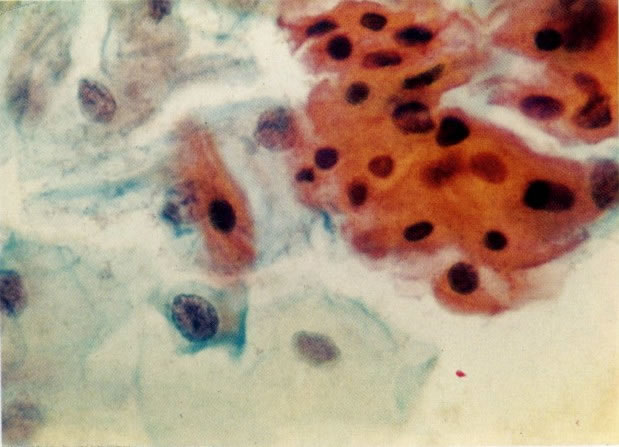
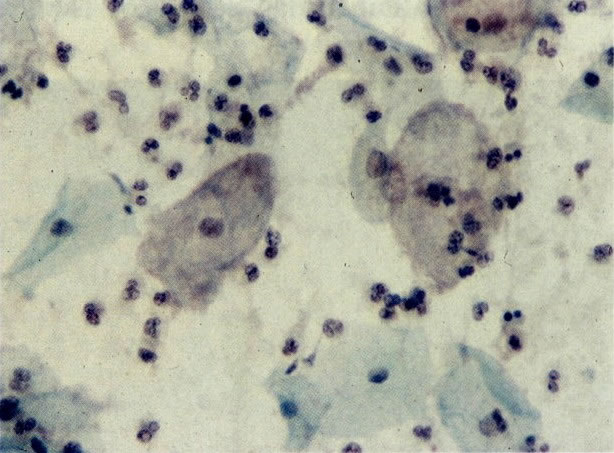
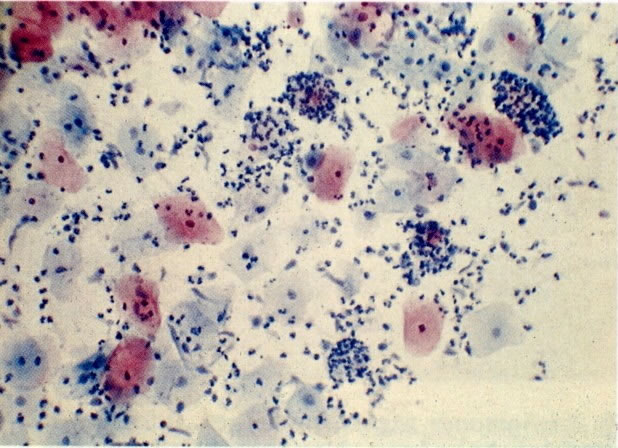
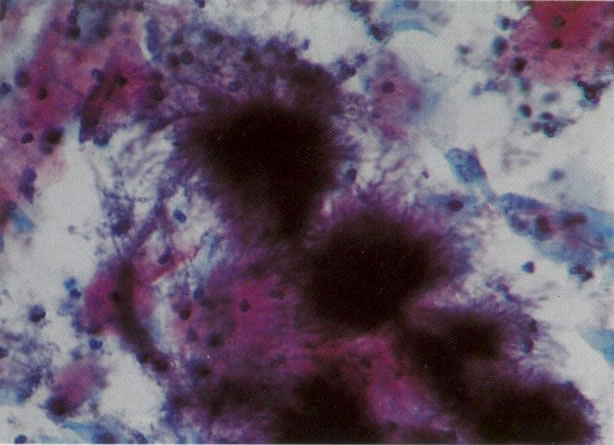
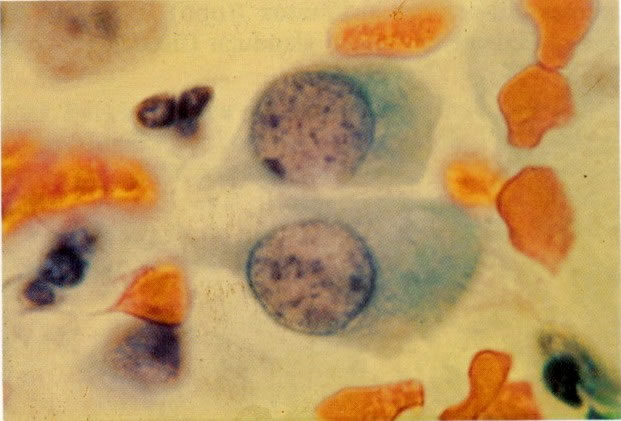
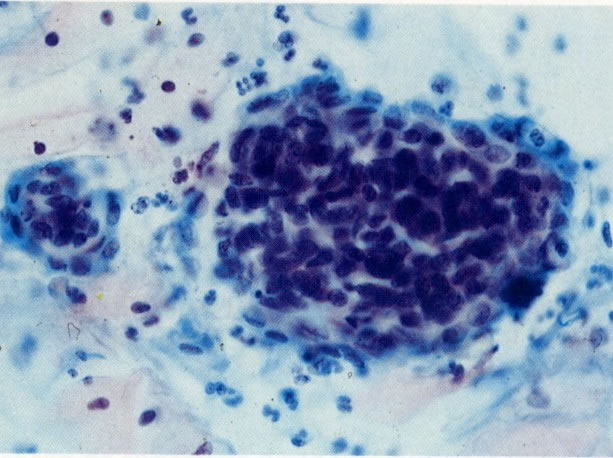
26. Células metaplásicas e de reserva. Células escamosas maduras estão presentes com células colunares endocervicais e grupos de células de reserva e metaplásicas imaturas. Notar a ampla variação da maturação (X 80)
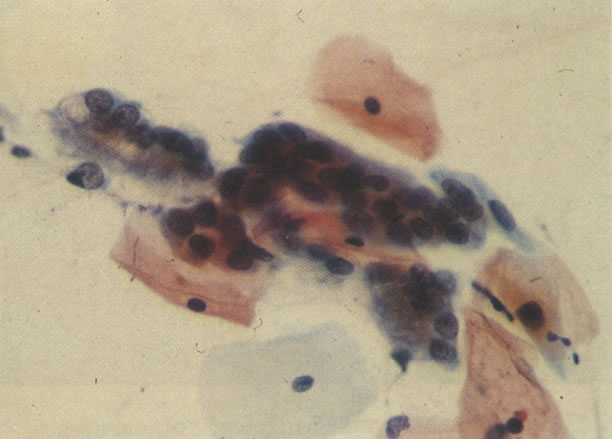
27. Células colunares endocervicais de reserva. Células colunares endocervicais são vistas de perfil com vacúolos no citoplasma. As células de reserva estão intimamente acondicionadas e mostram núcleos granulares hipercromáticos. (X 160)
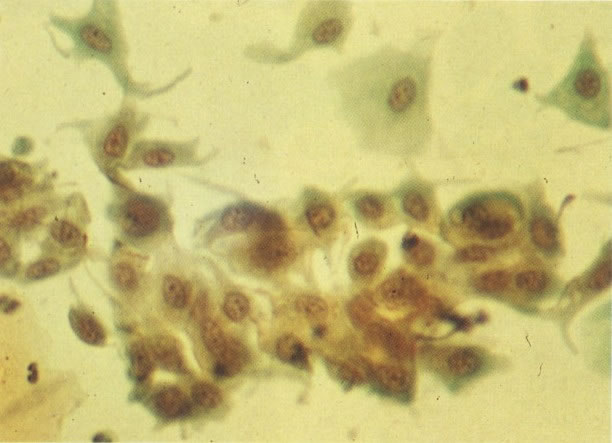
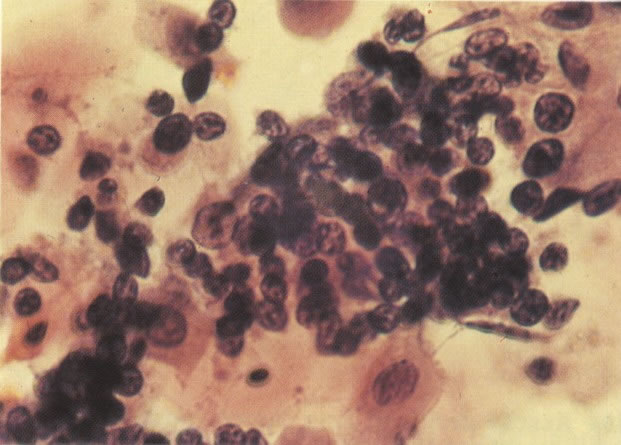
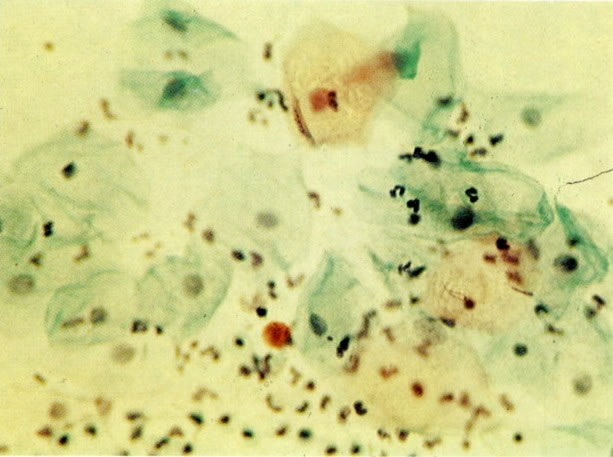
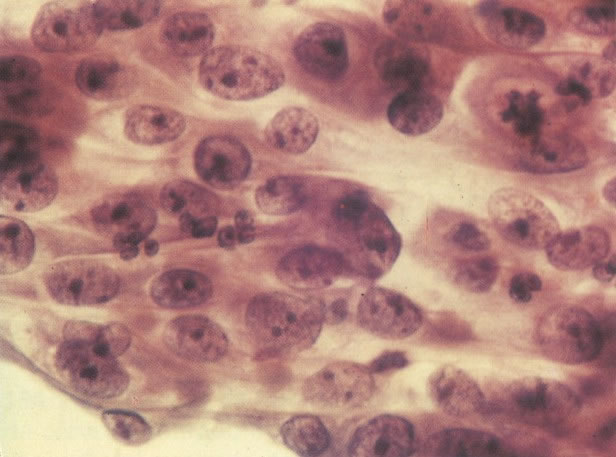
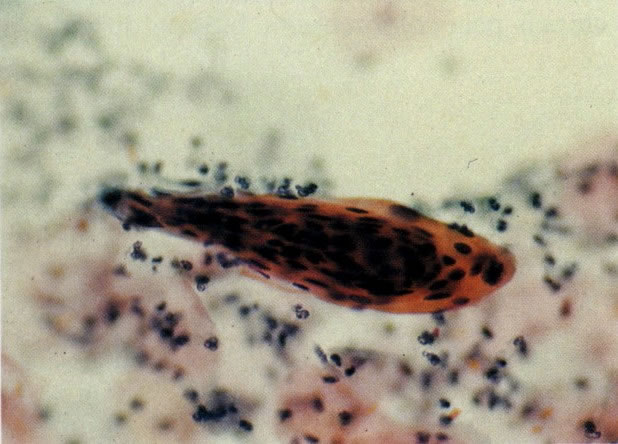
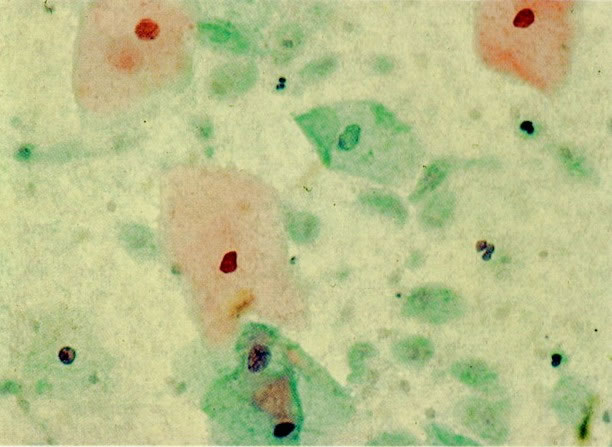
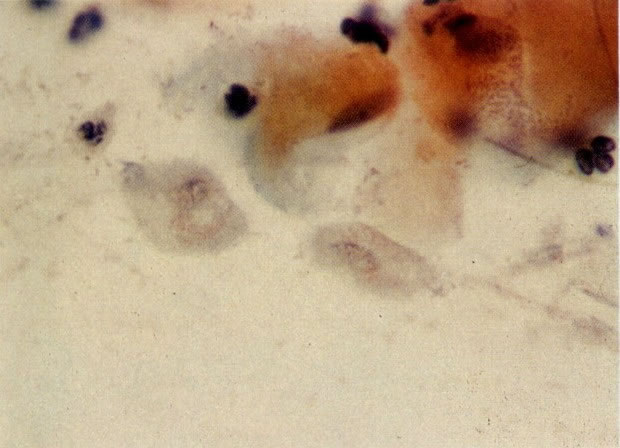
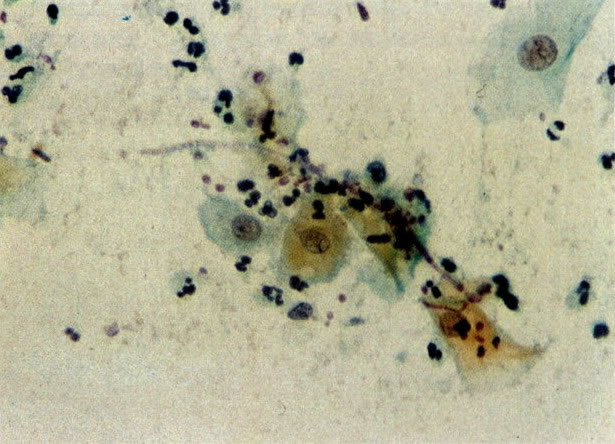
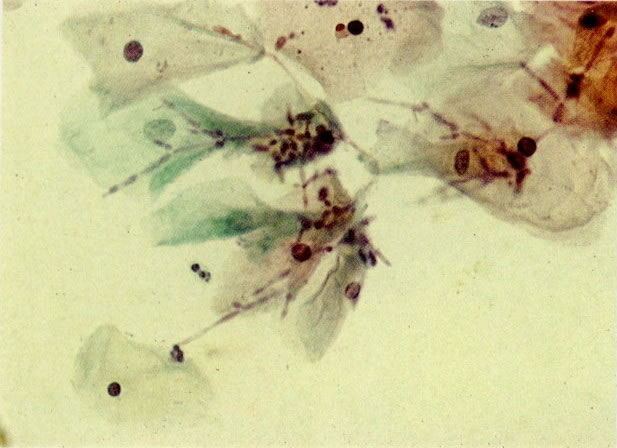
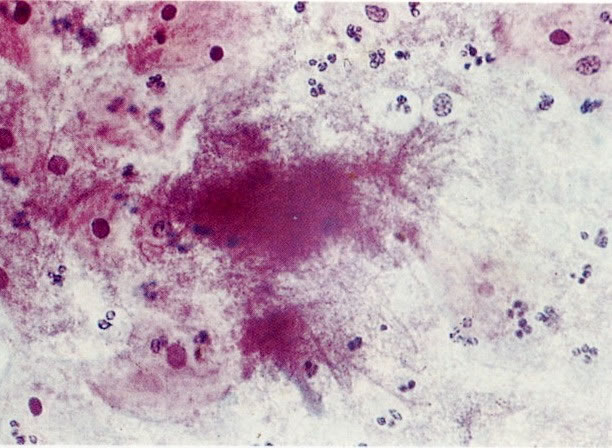
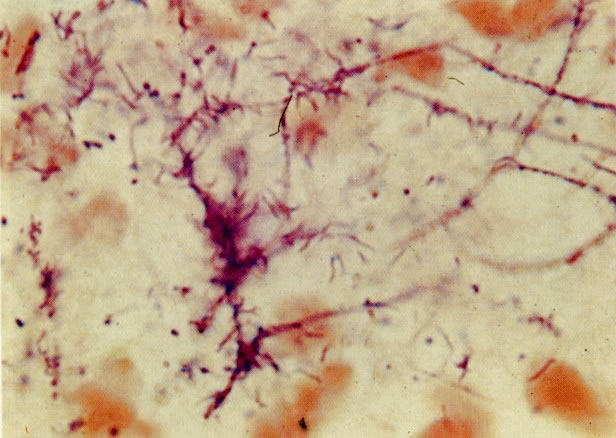
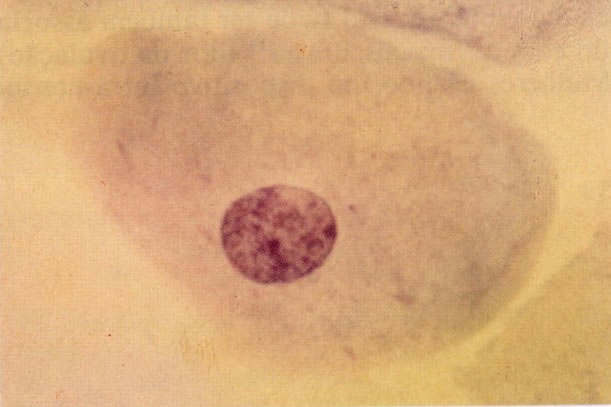
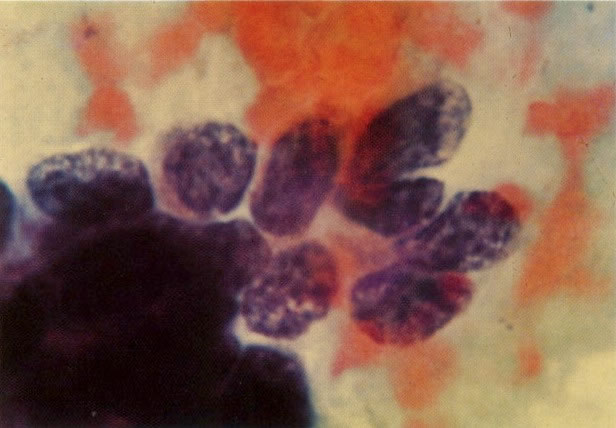
28. Células metaplásicas imaturas. Estas células têm mais citoplasma que as células de reserva, mas são ainda bastante imaturas. Por causa das expansões citoplasmáticas elas são chamadas de células em “aranha”. Esse aspecto indica que foram removidas à força por estratificação da cérvix, em lugar de serem células esfoliadas da camada superficial. (X 125)
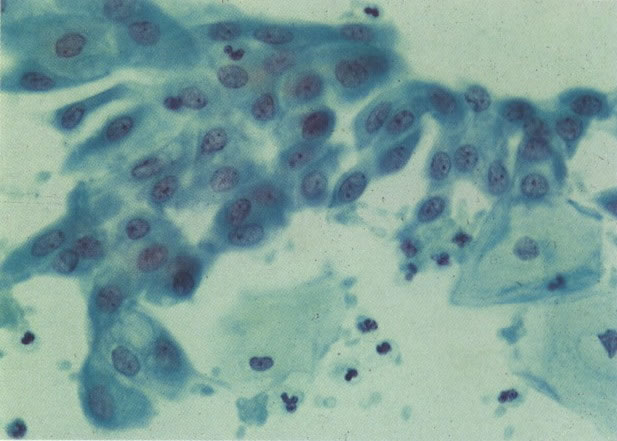
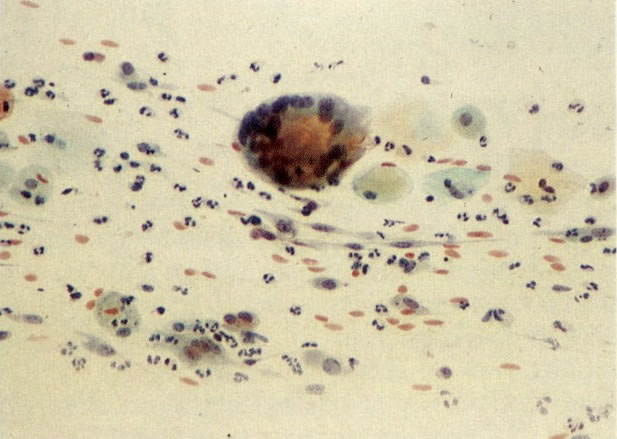
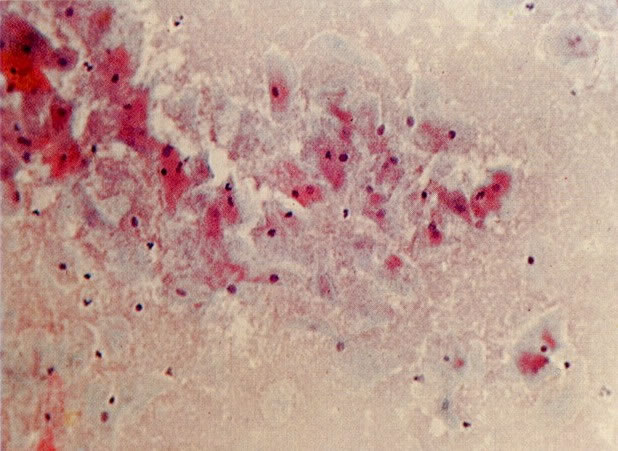
29. Metaplasia imatura. A apresentação de células metaplásicas no esfregaço cervical é muito variável. Neste campo células são vistas como uma placa, unidas frouxamente e os núcleos mostram nucléolos proeminentes. O aspecto pode refletir cicatrização de uma úlcera verdadeira ou reparo de um trauma (ver 99). (X 160)
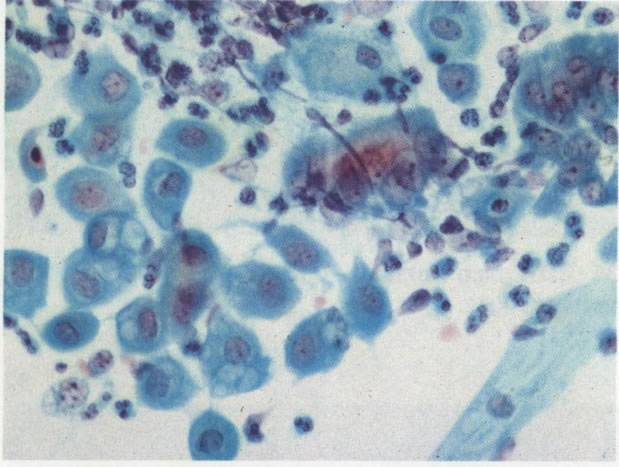
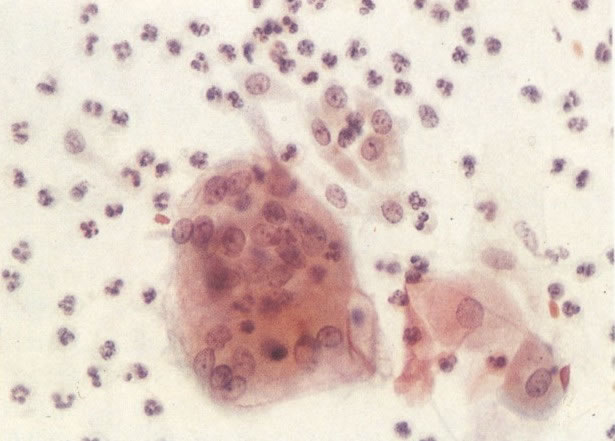
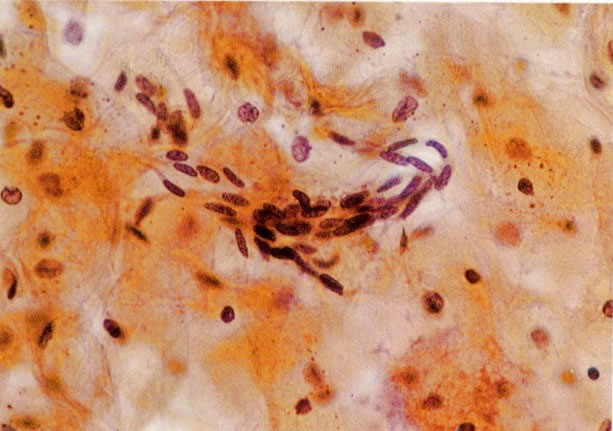
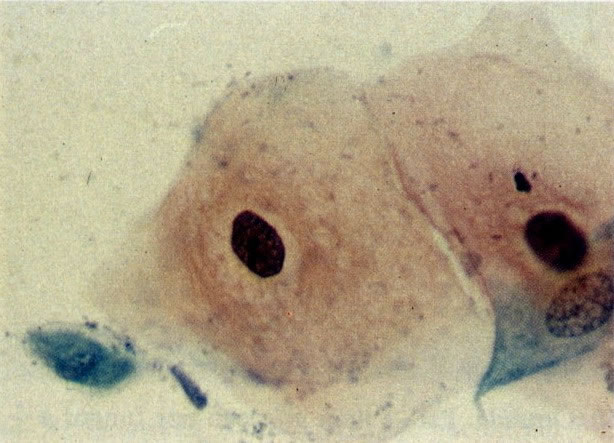
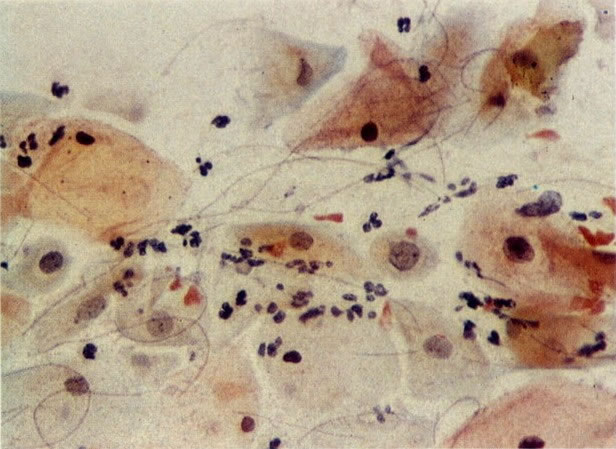
30. Células colunares endocervicais e metaplásicas. Neste esfregaço o citoplasma das células metaplásicas é mais arredondado e algumas mostrar vacuolização. Há um exsudato celular inflamatório misto com polimorfos e histiócitos e as células colunares endocervicais apresentam nucléolos evidentes. Parece provável que cervicite bem como uma zona de transformação típica estão presentes. (X 160).
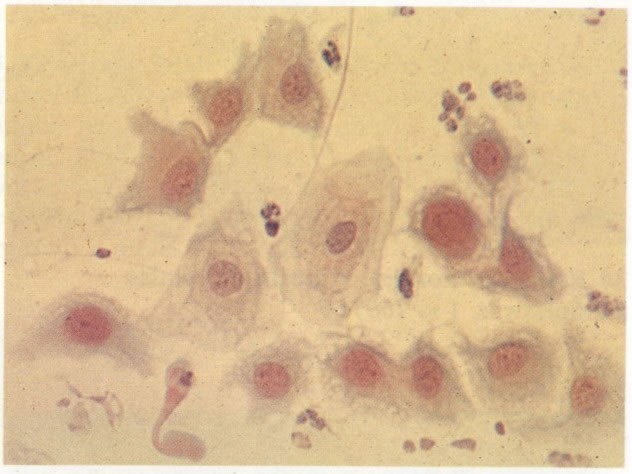
31. Células metaplásicas. Neste campo uma grande variação de células metaplásicas de maturidade variada estão juntas, assim, é possível comparar as alterações do padrão de cromatina nuclear e diferenciação citoplasmática das células de reserva e células metaplásicas quase maduras do tipo de células intermediárias. (X 125)
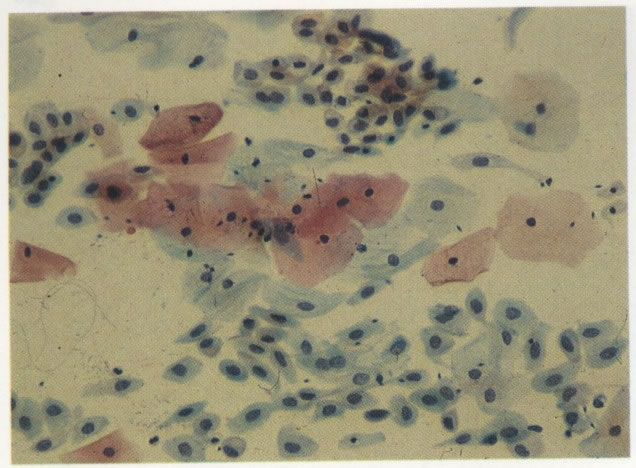
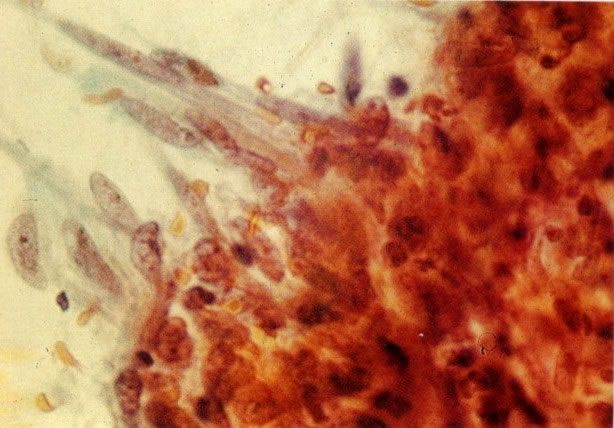
32. Esfregaço normal. Aspecto de células metaplásicas. (X 160).
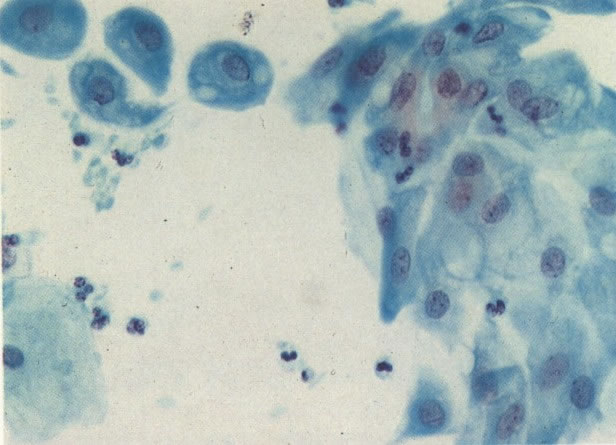
33. Esfregaço normal. Aspecto de células metaplásicas (X 125)
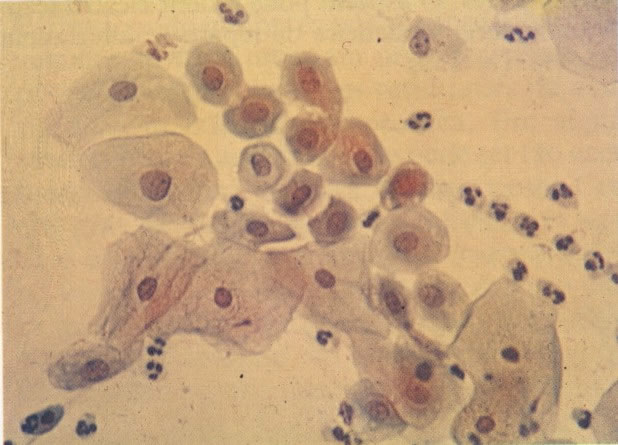
34. Esfregaço normal. Aspecto de células metaplásicas (X 160).
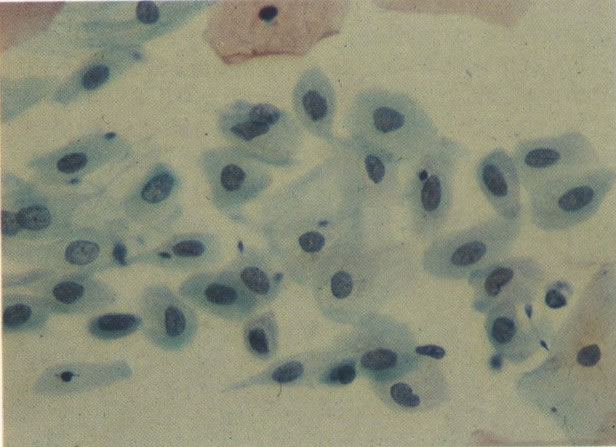
35. Esfregaço normal. Aspecto de células metaplásicas (X 160).
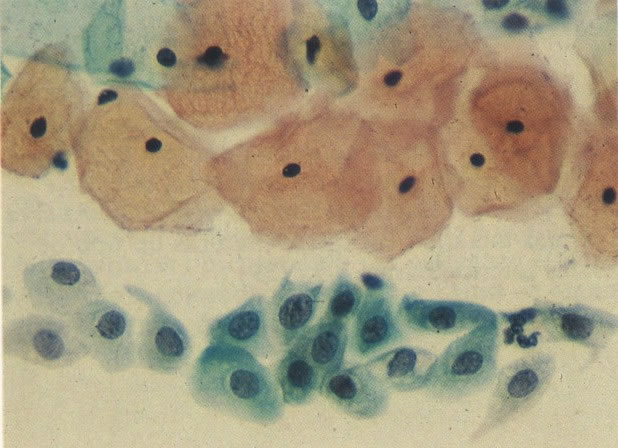
36. Esfregaço normal. Aspecto de células metaplásicas (X 160)
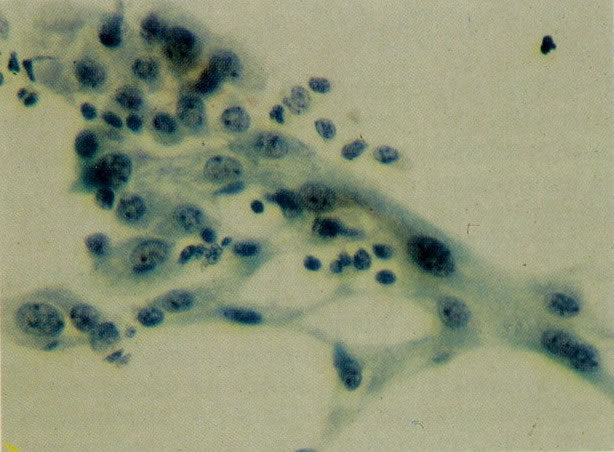
37. Esfregaço normal. Aspecto de células metaplásicas (X 160).
[Voltar]