Proteínas do líquido céfalo-raquidiano
Determinação quantitativa
1 – INTRODUÇÃO.
Proteínas de Líquor é um exame necessário ao arsenal diagnóstico, pois é ele quem, na grande maioria dos casos acaba por clarear, ou mesmo elucidar um diagnóstico, desde bacteriológico ou parasitário, até mesmo num caso de AVCH – acidente vascular cerebral hemolítico (vulgarmente chamado de “derrame”), quando não se dispõe de métodos de tomografia para se apurar a localização da ruptura do vaso, ou seja, para se determinar se o derrame é intra-dural, ou se é extra-dural. Extra-dural é o derrame que ocorre à nível de córtex cerebral e pode ter conseqüências apenas motoras, enquanto os intra-durais são rupturas de vasos ao nível de polígono de Wills (circuito de artérias que se forma da união das carótidas com a artéria basílica e irriga toda a base cerebral, ou mais precisamente, os núcleos da base que controlam as funções vitais). Se o derrame for extra-dural, o liquor é límpido, enquanto se ele for intra-dural, o liquor aparecerá avermelhado e se for analisado ao microscópio, evidenciará eritrócitos.
2 – PRINCÍPIOS DA ANÁLISE E USO ATUAL.
As proteínas do líquido cefalorraquidiano se originam principalmente por ultrafiltração do plasma através da parede capilar coroidal, ainda que algumas delas são próprias do líquor[1] e são sintetizadas pelo sistema nervoso central. O processo de ultrafiltração elimina a maioria das proteínas plasmáticas de modo que a concentração protéica total no líquor (150-450mg/l) é muito inferior a do soro (60-78mg/l).
As proteínas totais do LCR são medidas comumente por um procedimento turbidimétrico. Estes procedimentos empregam ácido sulfossalicílico com sulfato de sódio ou ácido tricloroacético ou ambos para precipitar as proteínas da amostra. A turbidez do precipitado é medido por espectrofotometria. A turbidez produzida pela albumina difere da produzida por uma massa igual de outras proteínas globulares, porém, tem-se observado que essas diferenças são menos pronunciadas quando se emprega ácido tricloroacético. Recentemente tem sido proposto o cloreto de benzetônio como agente precipitante.
Apesar do método do biureto apresentar baixo desenvolvimento de cor no intervalo de concentração protéica do LCR, se tem descrito um método Beckman Astra, que aplica um procedimento cinético e uma óptica muito sensível.
O método de Lowry é utilizado na Europa, porém é pouco utilizado nos Estados Unidos. Este método emprega o reativo de Follin-Ciocateu e consta dos seguintes passos:
1-a proteína reage com o cobre em solução alcalina;
2-o complexo cobre-proteína, a tirosina e o triptofano presentes reduzem os ácidos fosfotunguístico e fosfomolíbdico dando um produto colorido com lmax em 750nm.
Tem sido descrito ainda métodos de fixação de corantes. Quando a proteína se una ao corante azul brilhante de Coomassie G-250 se observa um deslocamento da absorção máxima de 465 a 595nm. A variação da absorção em 595nm se emprega para medir a quantidade de proteína presente. Tem sido realizadas diversas modificações para reduzir a variabilidade da intensidade da cor com as distintas proteínas, que incluem uma mistura de dodecilssulfato de sódio ou metanol e o emprego de outros corantes, como por exemplo o azul Serva G.
3 – MÉTODOS DE REFERÊNCIA E ESCOLHA:
A medição exata das proteínas do LCR é difícil porque estas se encontram em quantidades muito pequenas e as diferenças qualitativas que existem entre a quantidade de imunoglobulina e de albumina presentes na amostra do pacientes. Os métodos usados para a medição total no LCR podem ser sensíveis, porem dão resultados inexatos quando varia a relação albumina/globulina.
O método de fixação de corante para medição de proteínas totais em LCR é tecnicamente simples e requer apenas de 25 a 100ml de LCR, no entanto não é muito usado devido a dificuldade de se padronizar os resultados. A sensibilidade varia e a curva estándar é afetada pelas proteínas específicas presentes.
Como foi mencionado anteriormente, dado que o ensaio é simples e sensível, e por isso tem sofrido uma série de modificações para superar inconvenientes. A maioria delas tratam de reduzir a variabilidade das reações entre as proteínas. BioRad Laboratories (Richmond, CA.) comercializa um equipamento que emprega o método de fixação de corante.
O método do biureto está limitado a instrumentos que podem detectar variações de absorbância muito pequenas. Este método apresenta a vantagem da linearidade da reação ser independente da relação imunoglobulina/albumina..
O método de Lowry é empregado extensamente na Europa. Necessita apenas de 100 a 200ml de LCR, porém é difícil de executar, tem uma baixa linearidade. Entre as drogas que interferem com este método pode se encontrar os salicilatos, clorpromazina, tetraciclinas e sulfonamidas.
Nos Estados Unidos as proteínas totais do LCR são usualmente medidas por métodos turbidimétricos. Tanto o método do ácido sulfossalicílico como do ácido tricloroacético são aceitáveis e ambos concordam com os ensaios químicos específicos. Contudo, se tem comprovado que para um nível de 1000mg/l de proteína, o resultado do procedimento do ACA[2] com ácido tricloroacético pode variar entre 730 e 1.150mg/l. O método turbidimétrico é relativamente sensível e não é afetado pela maioria das drogas. Podem interferir a xantocromina e o metotrexato intratecal. A turbidez pode ser medida a comprimentos de ondas curtas (430nm) ou longas (650nm).
4 – AMOSTRAS.
O LCR pode ser conservado entre 2 e 8oC durante pelo menos cinco dias, se for protegido da evaporação. As amostras que não serão processadas neste período devem ser congeladas à -20oC, imediatamente após a extração.
5 – PROCEDIMENTOS: ENSAIO TURBIDIMÉTRICO COM ÁCIDO SULFOSSALICÍLICO.
5.1 – Princípio:
A proteína é precipitada como partículas finas brancas mediante a adição de ácido sulfossalicílico. A turbidez resultante é medida por espectrofotometria em 430nm.
5.2 – Reativos:
Ácido sufossalicílico, 30g/l (118mmol/l). Dissolver 30g de ácido sulfossalicílico em 800ml de água destilada e completar para um litro. Conservar em frasco âmbar. Estável durante um ano à temperatura ambiente.
Controle: Líquor controle.
5.3 – Ensaio:
Equipamento: espectrofotômetro para leituras em 430nm.
5.3.1 – Adicionar 1,0ml de ácido sulfossalicílico 3% à três tubos de ensaio devidamente identificados, um para o branco do aparelho, outro para o padrão e outro para a amostra.
5.3.2 – Adicionar 0,2ml de padrão ao tubo padrão.
5.3.3 – Adicionar 0,2ml de LCR amostra ao tubo teste. Adicionar 0,2ml de solução salina ao tubo branco.
5.3.4 – Se o LCR apresentar coloração muito intensa, prepara um branco para amostra utilizado 0,2ml de LCR e 1,0ml de solução salina.
5.3.5 – Cobrir todos os tubos com tampões plásticos ou uma película de RolopackÒ e inverter suavemente várias vezes.
5.3.6 – Deixar em repouso por 10 minutos em temperatura ambiente.
5.3.7 – Selecionar a absorbância em 430nm no espectrofotômetro e ler a absorbância do branco, do padrão e do teste.
5.3.8 – Se a concentração for maior que 2.000mg/l, fazer uma diluição 1:2 com solução salina e ler novamente.
5.4 – Cálculos:
5.4.1 – Corrigir a absorbância da amostra com o branco:
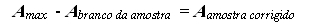
5.4.2 – Ler a absorbância corrigida a partir da curva estandar para obter a concentração protéica.
5.5 – Controles e padrões:
5.5.1 – Dado que o ácido sulfossalicílico produz graus distintos de turbidez com concentrações iguais de diferentes tipos de proteínas de LCR, é necessário construir uma curva usando um padrão que possua uma mínima relação albumina/globulina, com a amostra processada. Usualmente o LCR e o soro tem uma relação albumina/globulina muito parecida, de mod que pode empregar-se para construir a curva padrão, uma amostra de soro normal com as diluições apropriadas. A relação albumina/globulina do padrão deve encontrar-se entre 1,0 e 1,5 (adimensional).
5.5.2 – Para preparar a curva padrão, deve-se diluir um controle de soro que contenha 70g/l de proteínas totais com solução salina para obter 5 diluições cujas concentrações protéicas se encontrem entre 100 e 1.500ml/l.
Quadro I – Método de preparo da curva de calibração.

5.5.3 – Curva padrão: Construir a curva padrão representando a absorbância em 430nm contra a concentração de proteína. Deve resultar numa linha reta que passa pela origem.
5.5.4 – A curva padrão deve ser repetida quando houver uma troca de espectrofotômetro ou de lâmpada, ou quando o lote de controle de qualidade ou a amostra controle de qualidade não dão valores esperados.
6 – NOTAS:
6.1 – A primeira gota de LCR deve ser adicionada lentamente ao ácido sulfossalicílico. Se imediatamente se formar uma nuvem densa (precipitado), a concentração protéica está muito elevada e deverá se proceder uma diluição. Neste caso, o resto dos 0,2ml de amostra não deve ser adicionado ao ácido, devendo ser devolvido ao tubo original. A diluição do LCR poderá ser feita com salina.
6.2 – Se o LCR contiver eritrócitos, deve ser centrifugado antes de ser processado.
7 – INTERVALO DE REFERÊNCIA:
A maioria das proteínas do LCR se originam por ultrafiltração e apenas uma pequena quantidade é produzida dentro de sistema nervoso central. A composição das proteínas do sistema nervoso central difere das plasmáticas, já que se encontra uma proporção muito maior de proteínas de baixo peso molecular. Isto se atribui a barreira hematoencefálica que atua como um filtro. A albumina é a proteína predominante no LCR normal (55 a 75% do total).
Em estados patológicos, a barreira se torna mais porosa e aumenta a produção de proteínas, essencialmente IgG. Em qualquer desta condições, as proteínas se elevam. As proteínas totais medem comumente a integridade da barreira hematoencefálica e um aumento de proteínas no LCR usualmente está associado a um processo inflamatório. No quadro abaixo, é apresentado um resumo do aumentos de proteínas no LCR, que podem ser observadas em diversas enfermidades.
Quadro II - Patologias que elevam a concentração de proteínas no LCR.

2 Comentários

Olá, Estou fazendo minha monografia para conclusão de curso e o assunto é o Liquorgrama. Gostei muito do texto e gostaria de saber se há a possibilidade de me disponibilizar as refências do mesmo. Ficaria muito grata.
Att,
Mayara Aoyama
Mayara Aoyama:
Me esqueci de colocar no artigo. Usei basicamente o Kaplan (em espanhol) para escrevê-lo, mas apanhei alguns conceitos e mecanismos do Stryer (bioquímica).